Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2, khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng (dư), thu được 5,04 lít SO2 (đktc, sản phẩm khử duy nhất). Cho NaOH dư vào Z, được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là
A. 83,70%.
B. 38,04%
C. 60,87%
D. 49,46%.


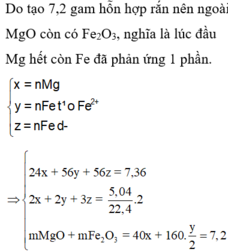
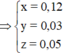
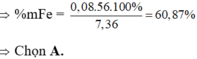

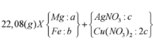
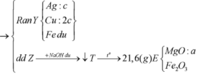
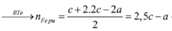
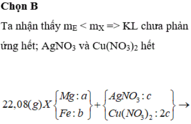
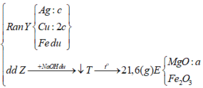
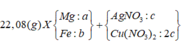
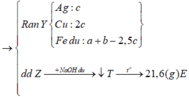
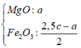
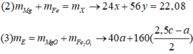
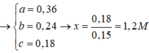
Đáp án : C
nSO2 = 0,225 mol
Chất rắn sau khi nung chỉ nặng 7,2 gam nên toàn bộ Mg và Fe không thể chuyển hết về oxit được (Lúc đó mrắn > 7,36), tức là trong Y phải có Fe dư —> AgNO3 và Cu(NO3)2 đã hết
Đặt a, b, c là số mol Mg, Fe phản ứng và Fe dư —> 24a + 56(b + c) = 7,36
Chất rắn Y gồm Ag, Cu và Fe dư, phần Ag, Cu do Mg (a) và Fe (b) đẩy ra nên 2a + 2b = nAg + 2nCu
Trong khi đó: nAg + 2nCu + 3nFe dư = 2nSO2 —> 2a + 2b + 3c = 0,225.2
Chất rắn cuối bài gồm MgO (a) và Fe2O3 (b/2) —> 40a + 160b/2 = 7,2
Giải hệ: a = 0,12 mol b = 0,03 mol c = 0,05 mol —> nFe = 0,08 mol —> %mFe = 60,87%