Nung nóng 19 gam hỗn hợp Fe, Al, Zn, Mg với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 27 gam chất rắn X. Thể tích dung dịch H2SO4 1M vừa đủ để phản ứng với chất rắn X là
A. 800 ml.
B. 200 ml.
C. 500 ml.
D. 400 ml.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Các phương trình phản ứng:
Hỗn hợp kim loại tác dụng với oxi:
Au, Ag không tác dụng với oxi
![]()
Phương trình phản ứng :
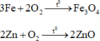
Rắn X gồm Au, Ag, CuO, Fe3O4 và ZnO tác dụng với dung dịch H2SO4 loãng:
Au, Ag không tác dụng với dung dịch H2SO4 loãng
![]()
Phương trình phản ứng
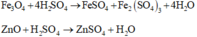
Tính toán:
Gọi M là kim loại chung cho Cu, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
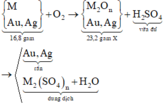
Bảo toàn khối lượng cho giai đoạn hỗn hợp kim loại tác dụng với oxi:
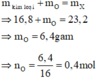
Theo sơ đồ thì cuối cùng O chuyển hết về O trong H2O. Bảo toàn nguyên tố O ta có:
n H 2 O = n O ⇒ n H 2 O = 0 , 4 mol
Bảo toàn nguyên tố H ta có:
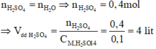

Đáp án A
mO = 23,2 – 16,8 = 6,4g ⇒ nO= 0,4 mol
2H+ + O2- → H2O
⇒ nHCl = 2nO = 2. 0,4 = 0,8 mol
⇒ VHCl = 0,8/2 = 0,4l = 400ml

nHCl = nCl- = 2nO = (23,2 - 16,8).2 : 18 = 0,8-> V = 400ml
=> Đáp án A

$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$2Cu + O_2 \xrightarrow{t^o} 2CuO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$MgO + 2HCl \to MgCl_2 + H_2O$
$CuO + 2HCl \to CuCl_2 + H_2O$
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
Gọi $n_{MgO} = a(mol) ; n_{CuO} = b(mol) ; n_{Al_2O_3} = c(mol)$
Bảo toàn khối lượng : $m_{O_2} = 23,2 - 16,8 = 6,4(gam)$
$n_{O_2} = 0,2(mol)$
$\Rightarrow 0,5a + 0,5b + 1,5c = 0,2(1)$
Theo PTHH :
$n_{HCl} =2 n_{MgO} + 2n_{CuO} + 6n_{Al_2O_3} = 0,8(theo (1))$
Suy ra : $V_{dd\ HCl} = \dfrac{0,8}{2} = 0,4(lít)$

Kim loại \(+O_2\underrightarrow{t^o}oxit\)
\(\Rightarrow m_{O_2}=23,2-16,8=6,4g\Rightarrow n_{O_2}=0,2mol\)
Phản ứng của chất rắn X và HCl.
\(PTHH:O^{2-}+2H^+\rightarrow H_2O\)
0,2 0,4
\(V_{HCl}=\dfrac{0,4}{2}=0,2l=200ml\)
Ta có nO = (27-19) : 16 = 0,5
=> nH2SO4 = 0,5 mol
=> V = 500ml
=> Đáp án C