Cho hỗn hợp A gồm m gam các chất Al2O3 và Al vào 56,5 gam dung dịch H2SO4 98%, thu được 0,336 lít khí SO2 thoát ra (đktc) cùng dung dịch B và a gam hỗn hợp rắn D. Lọc lấy D và chia làm 2 phần bằng nhau:
+ Phần 1: Cho tác dụng với dung dịch HNO3 vừa đủ, sau phản ứng thu được dung dịch X chỉ chứa muối sunfat cùng 1,4 lít hỗn hợp khí không màu có khối lượng là 2,05 gam, có khí hóa nâu trong không khí. Dẫn từ từ đến dư dung dịch NaOH 1M vào X, thấy lượng NaOH dùng hết tối đa là 130 ml.
+ Phần 2: Nung trong không khí đến khối lượng không đổi thu được rắn Y có khối lượng giảm 1,36 gam so với lượng rắn đem đốt. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
A. 14.
B. 12.
C. 15.
D. 13.

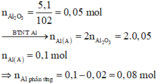
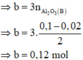
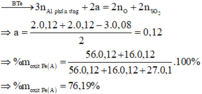

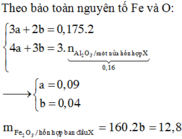


Đáp án D
nH2SO4 = 0,565 mol ; nSO2 = 0,015 mol
+) Phần 1 : Mkhí = 32,8g ; nkhí = 0,0625 mol
Hỗn hợp khí không màu có 1 khí hóa nâu là NO và N2O
=> nNO = 0,05 ; nN2O = 0,0125 mol
Muối thu được là muối sunfat => có S trog D
Qui hỗn hợp D về dạng : Al (x mol) ; O (y mol) ; S (z mol)
Giả sử phản ứng D + HNO3 tạo t mol NH4+
Bảo toàn e : 3nAl + 6nS = 2nO + 3nNO + 8nN2O + 8nNH4
=>3x + 6z = 2y + 0,15 + 0,1 + 8t(1)
Muối sunfat thu được có : NH4+ ; Al3+ ; SO42-
Bảo toàn điện tích : nNH4 + 3nAl = 2nSO4
=>t + 3x = 2z(2)
Khi Cho dung dịch muối này phản ứng với NaOH vừa đủ thì :
Al3+ + 4OH- -> AlO2- + 2H2O
NH4+ + OH- -> NH3 + H2O
=> nNaOH = 4x + t = 0,13(3)
+) Phần 2 : (Al ; O ; S) + O2(không khí) -> ( 0,5x mol Al2O3) + SO2 ↑
=> mgiảm = mS – mO thêm
=>1,36 = 32z – 16.(1,5x – y)(4)
Giải hệ (1,2,3,4) => x = y = 0,03 ; z = 0,05 ; t = 0,01 mol
Vậy D có : 0,02 mol Al2O3 ; 0,02 mol Al ; 0,1 mol S
Bảo toàn e : 2nSO2 + 6nS = 3nAl pứ => nAl pứ = 0,21 mol
nH2SO4 = 3nAl2O3 pứ + (1,5nAl + nSO2 + nS)
=> nAl2O3 = 0,045 mol
Vậy hỗn hợp đầu có : 0,065 mol Al2O3 và 0,23 mol Al
=> m = 12,84g