Trộn lẫn V ml dung dịch (gồm NaOH và B a O H 2 ) có pH = 12 với V ml dung dịch gồm HCl 0,02 M và H 2 S O 4 0,005M được 2V ml dung dịch Y. Dung dịch Y có pH là
A. 3
B. 4
C. 2
D. 1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ví dụ 5 :
n KOH = 0,02.0,35 = 0,007(mol)
n HCl = 0,08.0,1 = 0,008(mol)
$KOH + HCl \to KCl + H_2O$
n HCl pư = n KOH = 0,007(mol)
=> n HCl dư = 0,008 - 0,007 = 0,001(mol)
V dd = 0,02 + 0,08 = 0,1(mol)
=> [H+ ] = CM HCl dư = 0,001/0,1 = 0,01M
=> pH = -log(0,01) = 2

Chọn đáp án A
Phản ứng: NaOH + HCl → NaCl + H2O
chọn V = 1000 mL ⇔ 1 lít ⇒ có nNaOH = 0,01 mol và nHCl = 0,03 mol.
⇒ sau phản ứng thu được 0,01 mol NaCl và còn dư 0,02 mol HCl.


\(n_{OH^-}=0.01\cdot10^{-3}\cdot V\left(mol\right)\)
\(n_{H^+}=0.03\cdot10^{-3}\cdot V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(n_{H^+\left(dư\right)}=0.03\cdot10^{-3}V-0.01\cdot10^{-3}V=0.02\cdot10^{-3}V\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.02\cdot10^{-3}}{2}=0.01\cdot10^{-3}=10^{-5}\)
\(pH=-log\left(10^{-5}\right)=5\)

Chọn đáp án C
Cho V = 1 lít để xử lý cho dễ hiểu các bạn nhé !
Ta có
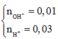
![]()
![]()
Đáp án là C
Chọn V=1 lít