Trong hợp kim Al – Ni cứ 10 mol Al thì có 1 mol Ni. Phần trăm khối lượng của hợp kim này là phương án nào sau đây.
A. 81% Al và 19% Ni.
B. 82% Al và 18% Ni.
C. 83% Al và 17% Ni.
D. 84% Al và 16% Ni.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
Khối lượng Al là mAl = 27 x 10 = 270 (g)
Khối lượng Ni là mNi= 59 . 1 = 59 (g)
Khối lượng hỗn hợp mhh = mAl + mNi = 270 + 59 = 329 (g)
Thành phần % theo khối lượng
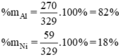
Trong hợp kim Al – Mg, cứ có 9 mol Al thì có 1 mol Mg. Thành phần phần % khối lượng của hợp kim là ?


1,a,Gọi \(n_{Al}=a\left(mol\right)\rightarrow n_{Mg}=0,5a\left(mol\right)\)
\(\rightarrow27a+24.0,5b=7,8\\ \Leftrightarrow a=0,2\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Mg}=0,1\left(mol\right)\end{matrix}\right.\)
b, \(\rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Mg}=0,1.24=2,4\left(g\right)\end{matrix}\right.\)
2, \(n_{O_2}=\dfrac{0,16}{32}=0,005\left(mol\right)\)
PTHH: 2HgO --to--> 2Hg + O2
0,01<- 0,05
\(\rightarrow m_{Hg}=0,01.201=2,01\left(g\right)\)

\(n_{Mg}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(24a+27b=15\left(1\right)\)
Bảo toàn e :
\(2a+3b=0.1\cdot\left(2+3+1+8\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=0.4,b=0.2\)
\(\%Mg=64\%,\%Al=36\%\)

Đặt: nAl= x (mol) ; nZn= y (mol)
2Al + 6H2SO4(đ) \(\rightarrow\) Al2(SO4)3 + 3SO2 + 6H2O
Zn + 2H2SO4(đ) \(\rightarrow\) ZnSO4 + SO2 + 2H2O
Ta có : mhh= 27x + 65y= 11,9g (1)
nSO2= \(\dfrac{3}{2}\)x + y =\(\dfrac{8,96}{22,4}\)=0,4 (mol) (2)
Từ (1) và (2) => x=0,2 ; y=0,1
=> %Al= \(\dfrac{0,2.27}{11,9}.100\)=45,37%
%Zn=100- 45.37= 54,63%

a,gọi mol Al là x(mol)====> nMg=1/2 x( mol)
ta có: mhh= 7,8= 27x+ \(\frac{1}{2}x.24\) ===> x=0,2( m0)=n Al
==> n Mg=0,1(mol)
b, m Al= 5,4 g===> mMg= 7,8-5,4=2,4(g)
c, 4Al+ 302===> 2Al203
0,2 0,1
2Mg+ o2=======> 2Mg0
0,1 0,1
tổng số nO2=0,2( moI)
==> m02= 0,2.32=6,4 g

Mg ko pư vs HCl
Gọi số mol của Fe là a(a>0)
=> nAl= 2a(mol)
nMg = 3/2 a (mol)
nH2=49,28/22,4=2,2(mol)
PTHH
Fe + 2HCl ------> FeCl2 + H2
a a (mol)
2Al + 6HCl ------> 2AlCl3 + 3H2
2a 3a (mol)
=> nH2 = a+3a=4a=2,2(mol)
=> a=0,55 = nFe
=> nAl = 2a = 1,1 ( mol)
nMg = 0,825 ( mol)
%mFe = ( 0,55.56)/(0,55.56 + 1,1.27 + 0,825.24) . 100% = 38,35 %
%mAl =(1,1.27)/(0,55.56 + 1,1.27 + 0,825.24) . 100% = 37%
%mMg = 100% - %mFe - %mAl = 100% -38,36%-37% = 24,65%
( kết quả có thể khác , bn tự lm lại theo hướng này )
#Học-tốt
\(\%m_{Al}=\dfrac{27.10}{27.10+59.1}.100\approx82\%\\ \Rightarrow\%m_{Ni}\approx18\%\\ \Rightarrow B\)