Tiến hành điện phân 100 gam dung dịch chứa 0,2 mol FeCl3 ; 0,1 mol CuCl2 và 0,16 mol HCl (với điện cực trơ) đến khi bắt đầu có khí thoát ra ở hai điện cực thì dừng điện phân. Đem phần dung dịch sau điện phân tác dụng hết với 150 gam dung dịch AgNO3, kết thúc phản ứng thu dược 90,08 gam kết tủa và dung dịch chứa một muối duy nhất có nồng độ a%. Giá trị của a gần nhất với giá trị nào sau đây ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Trong X có CuCl2, FeCl2, FeCl3 và HCl với nCuCl2 = 7,68/64 = 0,12 (BTNT.Cu)
Theo phương trình phản ứng: Cu + 2FeCl3 → CuCl2 + 2FeCl2 ⇒ nFeCl2
= 0,12 . 2 = 0,24
Trường hợp 1: Trong X có nFeCl3 = nHCl = nCuCl2 = 0,12 và nFeCl2 = 0,24
⇒ nFeCl3 ban đầu 12 + 0,24 = 0,36 = 3nHCl ⇒ Thỏa đề bài

Trường hợp 2: Trong X có nFeCl3 = nHCl = nFeCl2 = 0,24 và nCuCl2 = 0,12
⇒ nFeCl3 ban đầu = 0,24 + 0,24 = 0,48 = 2nHCl ⇒ Không thỏa đề bài ⇒ Loại.

Đáp án D
nFe3+ = 0,08 (mol); H+ còn dư
Dd Y gồm: FeCl3 , FeCl2, CuCl2, HCl dư
Qúa trình điện phân dd Y
Catôt (Fe3+, Fe2+, Cu2+, H+) Anốt (Cl-)
Fe3+ +1e → Fe2+ 2Cl- + 2e → Cl2
0,08 → 0,08
Cu 2+ + 2e → Cu
x → 2x
2H+ + 2e → H2
Khi catốt có khí thì ngừng => chưa xảy ra phản ứng điện phân H+
Gọi nCuCl2 = x (mol)
=> ne trao đổi = 0,08 + 2x = 2nCl2
mdd giảm = mCu + mCl2 = 64x + 71( 0,04 + x) = 13,64
=> x = 0,08 (mol)
Gọi số mol Fe3O4 và Fe2O3 lần lượt là a và b mol
BTKL: 232a + 160b + 0,08.64 = 27,2 (1)
2Fe3+ + Cu → Fe2+ + Cu2+
=> nFe3+ sau = nFe3+ ban đầu – nCu
<=> 2a + 2b – 2.0,08 = 0,08 (2)
Từ (1) và (2) => a = 0,04 ; b = 0,08 mol
BTNT Fe: nFe2+ = nFe bđ – nFe3+ sau = 0,2 mol
nH+ dư = nHCl dư = nHCl bđ – 3nFeCl3 – 2nFeCl2 – 2nCuCl2 = 0,1 mol
Sau điện phân thì nFe2+ = 0,28 (mol); nCl- = 0,66 (mol); nH+ = 0,1 (mol)
Khi cho AgNO3 vào:
3Fe2+ + 4H+ + NO3- →3Fe3+ + NO + H2O
0,075← 0,1
Ag+ + Fe2+ → Fe3+ + Ag↓
(0,28 – 0,075)→ 0,205
Ag+ + Cl- → AgCl↓
0,66 → 0,66
m↓ = mAg + mAgCl = 0,205.108 + 0,66.143,5 = 116,85(g)

Bạn lấy bài này trong đề nào vậy? Đề bài thực sự là quá hay! Đề thi THPT Quốc gia năm nay chắc sẽ có dạng như thế.
*) Xét phản ứng điện phân:
Bên Catot, thứ tự điện phân là: \(Fe^{3+};Cu^{2+};H^+;Fe^{2+};H2O\)
Bên Anot, thứ tự điện phân là: \(Cl^-;H2O\)
Nhưng vì chỉ điện phân đến khi 2 bên đều BẮT ĐẦU thoát khí nên:
-) ở Catot, chỉ có \(Fe^{3+};Cu^{2+}\) bị điện phân
-) ở Anot, chỉ có \(Cl^-\) bị điện phân
Suy ra, dd A còn lại sau khi điện phân là: \(FeCl_2;HCl\)
Trong đó: \(n_{FeCl2}=n_{FeCl3}=0,2\left(mol\right);n_{HCl}=0,16mol\)
\(m_{ddA}=100-m_{CuCl2}=86,5\left(g\right)\)
*) Xét phản ứng của ddA với dd AgNO3:
+) Phản ứng tạo kết tủa chắc chắn có Ag và AgCl.
\(n_{AgCl\downarrow}=n_{HCl}+2n_{FeCl2}=0,56\left(mol\right)\)
\(n_{Ag\downarrow}=\dfrac{90,08-0,56.143,5}{108}=0,09\left(mol\right)\)
\(n_{AgNO3}=n_{AgCl\downarrow}+n_{Ag\downarrow}=0,65\left(mol\right)\)
+) Phản ứng tạo 1 muối duy nhất nên muối đó chỉ có thể là \(Fe\left(NO_3\right)_3\)
\(n_{Fe\left(NO_3\right)_3}=n_{FeCl2}=0,2mol\)
+) Phản ứng chắc chắn tạo hỗn hợp khí dạng \(N_xO_y\), tạm gọi là khí X
Ta chỉ cần tìm khối lượng khí X:
Có ngay số mol nước sinh ra sau phản ứng là:
\(n_{H2O}=\dfrac{1}{2}n_{HCl}=0,08\left(mol\right)\)
Bảo toàn khối lượng:
\(m_{FeCl2;HCl}+m_{AgNO3}=m_{\downarrow}+m_{Fe\left(NO_3\right)_3}+m_X+m_{H2O}\\ \Rightarrow m_X=1,82g\)
*) Xét toàn bộ quá trình phản ứng:
dd sau cùng chỉ là dd \(Fe\left(NO_3\right)_3\)
\(m_{ddFe\left(NO_3\right)_3}=m_{ddA}+m_{ddAgNO3}-m_{\downarrow}-m_{X\uparrow}=144,6\left(g\right)\)
\(\Rightarrow a\%=\dfrac{m_{Fe\left(NO_3\right)_3}}{m_{ddFe\left(NO_3\right)_3}}=\dfrac{0,2\cdot242}{144,6}\approx33,47\%\)
Chọn D





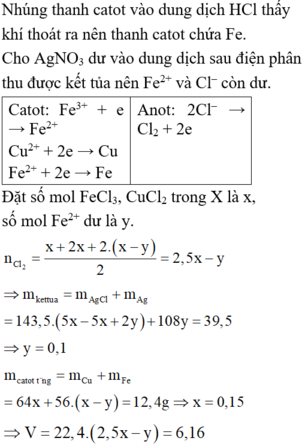






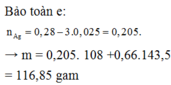
Chọn đáp án A