Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thuộc nhóm:
A. IA.
B. IIIA.
C. IVA.
D. IIA.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Theo đề bài ta có : 2Z + N = 40
N ≥ Z . Vì vậy ta có : 3Z ≥ 40, do đó Z ≤ 40/3 = 13,3 (1)
Măt khác : N/Z ≤ 1,5 → N ≤ 1,5Z
Từ đó ta có : 2Z + N ≤ 2Z + 1,5Z; 40 ≤ 3,5Z
→ Z ≥ 40/3,5 = 11,4 (2)
Tổ hợp (1) và (2) ta có : 11,4 ≤ Z ≤ 13,3 mà z nguyên. Vậy Z= 12 và Z = 13.
Nếu Z = 12 thì N = 16 và A = 28 (trái với đề bài A < 28)
Vậy Z = 13. Đó là nguyên tố nhôm (Al).
Vị trí của nhôm trong bảng tuần hoàn :
+ Ô số 13 ;
+ Chu kì 3 ;
+ Nhóm IIIA.

Đáp án A.
Ta xét hai trường hợp sau:
- Nếu X và Y thuộc chu kì nhỏ thì ta có
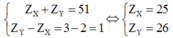
(loại do nhóm IIA và IIIA)
Nếu X và Y thuộc chu kì lớn thì ta có
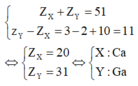
Nhận xét các đáp án:
A đúng: Ca không khử được ion Cu2+ trong dung dịch vì khi cho Ca vào dung dịch chứa Cu2+ thì Ca phản ứng với H2O có trong dung dịch trước:
![]()
Sau đó Cu2+ sẽ phản ứng với OH-:
![]()
B sai: Ở nhiệt độ thường Ca khử được H2O:
![]()
C sai: Hợp chất của Ca với oxi là CaO
D sai: Trong nguyên tử Ca có 20 proton

Chọn B
![]()
X và Y thuộc cùng một chu kì và hai nhóm liên tiếp (nhóm IIA và IIIA) nên ta có các trường hợp sau


Ở nhiệt độ thường X khử được nước, không khử được ion C u 2 + trong dung dịch (do sẽ phản ứng với nước trước), hợp chất với oxi có dạng CaO, trong X có 20 proton.

ZX +ZY =51→X,Ythuộc cùng một chu kì lớn trong bảng tuần hoàn. Khi đó, nhóm IA và IIA bị ngăn cách bởi các nguyên tố nhóm B, do đó ta có:
ZX +10+1= ZY ; ZX +ZY =51→ ZX =20 (Ca) và ZY = 31 (Ga)
A. Đúng. Trong dung dịch, Ca khử nước trước tạo thành Ca(OH)2 nên không khử được Cu2+.
B. Sai. Hợp chất với oxi của X có dạng XO (CaO).
C. Sai. Trong nguyên tử của nguyên tố X có 20 proton.
D. Sai. Ở nhiệt độ thường canxi có thể khử được nước tạo thành dung dịch Ca(OH)2 và giải phóng khí H2.
Chọn đáp án A.