A gồm: 0,01 mol Na+, 0,02 mol Ca2+; 0,02 mol và a mol ion X. Ion X và a là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Bảo toàn điện tích: ax = 0,01 + 0,02 x 2 - 0,02 = 0,03
Chỉ có D thõa mãn; vì OH- không tồn tại chung dung dịch với HCO3-

Đáp án A
TH1: Ion X có điện tích= -1 ⇒ nX = 0,01 + 0,02×2 – 0,02 = 0,03
⇒ chọn A hoặc D
Loại D vì OH- và HCO3- không cùng tồn tại trong cùng 1 dung dịch
Đáp án A.
TH2: Ion X có điện tích = -2 ⇒ nX = (0,01 + 0,02×2 – 0,02): 2 = 0,015 ( Không thỏa mãn đáp án)

Tổng ion dương là 0,04 mol và tổng ion âm là 0,02 + a => a = 0,02
=> Đáp án B

Đáp án A
Để dung dịch X tồn tại thì Y là NO3- hoặc Cl-
Ta thấy có đáp án A thỏa mãn định luật bảo toàn điện tích:
0,01.1 + 0,02.2 = 0,02.1 + 0,03.1

Giải thích:
Ta thấy cốc nước có chứa các ion Ca2+, Mg2+, HCO3-, Cl- => đây thuộc nước cứng toàn phần
Đáp án B

Đáp án B
![]() có thể làm mềm nước cứng do tạo tủa trực tiếp
có thể làm mềm nước cứng do tạo tủa trực tiếp
Với ![]()
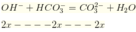
Để làm mềm nước thì kết tủa hoàn toàn ![]()
![]()
![]()
![]()
nên không thể làm mềm nước bằng C a ( O H ) 2

Đáp án A
- Khi đun sôi: 2HCO3 → CO32- + CO2 + H2O
Mol 0,05 → 0,025
- Ta thấy tổng số mol (Ca2+, Mg2+) > số mol CO32-
=> Trong dung dịch sau khi đun có Ca2+, Mg2+ và Cl-
=> Đây là loại nước cứng vĩnh cửu

Đáp án A
Ta có thể loại ngay đáp án C và D do CaCO3 kết tủa và do phản ứng sau xảy ra nên không thể tồn tại trong một dung dịch
Áp dụng định luật bảo toàn điện tích cho hỗn hợp dung dịch trên ta được a = 0,03 mol