Cho 12,1 gam hỗn hợp kim loại gồm Fe và Zn tan hết trong dung dịch HCl (vừa đủ) thấy thoát ra 4,48 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng thu được chất rắn có khối lượng là
A. 24,6 gam.
B. 26,3 gam.
C. 19,2 gam.
D. 22,8 gam.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
M → Mn+ + ne
1,25 → 1,25nx
Zn → Zn2+ + 2e
x → 2x
Cl2 + 2e → 2Cl-
0,2 → 0,4
2H+ + 2e → H2
0,5 ← 0,25
BT e ⇒1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
(1)(2) ⇒ (1,25M +65)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)

Đáp án A
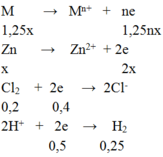
Bảo toàn e ⇒1,25nx + 2x = 0,4 + 0,5 = 0,9 (1)
Mặt khác: 1,25M + 65M = 19 (2)
Từ (1) và (2) ⇒ (1,25M +65M)/(1,25n + 2) = 19/0,9 ⇒ n = 2; M = 24(Mg)

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ n_{Al}=a;n_{Fe}=b\\ 27a+56b=8,3\\ 1,5a+b=\dfrac{5,6}{22,4}=0,25\\ a=b=0,1\\ m_{Al}=27\cdot0,1=2,7g\\ m_{Fe}=8,3-2,7=5,6g\\ a=\dfrac{3a+2b}{500}\cdot36,5=3,65\%\\ m_{ddsau}=508,3-0,25\cdot2=507,8g\\ C\%_{AlCl_3}=\dfrac{133,5a}{507,8}=2,63\%\\ C\%_{FeCl_2}=\dfrac{127b}{507,8}=2,50\%\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`
12,1 gam (Fe, Zn) + HCl (vừa đủ) → muối FeCl 2 , ZnCl 2 + H 2
Đáp án là C