Trong một bình thể tích 10 lít chứa 20g hidro ở 27 ° C. Tính áp suất khí trong bình.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Áp dụng phương trình Menđêlêep- Clapêron
P V = m μ H 2 R T với μ H 2 = 2 g / m o l , T = 300 0 K

Đáp án: A
Ta có:
- Trạng thái 1: T 1 = 27 + 273 = 300 K p 1 = 1 a t m V 1 = n V = 1000.4 = 4000 l
- Trạng thái 2: T 2 = 42 + 273 = 315 K p 2 = ? V 2 = 2 m 3 = 2000 l
Áp dụng phương trình trạng thái của khí lý tưởng, ta có:
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 = p 1 V 1 T 2 T 1 V 2 = 1.4000.315 300.2000 = 2,1 a t m

Gọi n là số mol khí cacbonic chứa trong bình: n = m/ μ , trong đó M là khối lượng khí cacbonic có trong bình, μ là khối lượng mol của khí cacbonic.
Ta có n = 100 mol
Nếu gọi V 0 là thể tích của lượng khí cacbonic ở điều kiện chuẩn ( p 0 = 1,013. 10 5 Pa; T 0 = 273 K) thì V 0 = n v 0
Áp dụng phương trình trạng thái của khí lí tưởng cho lượng khí cacbonic:
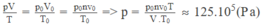

Chọn đáp án C
? Lời giải:
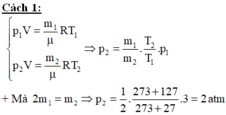
Cách 2:
Ta xét trạng thái của lượng khí còn lại trong bình sau khi nhiệt độ tăng lên 127 độ C. Khi đó nó chiếm thể tích cả bình.nhưng khi chưa mờ van và nhiệt độ trong bình còn 27 độ c thì nó chiếm một phần hai thể tích cả bình


Đáp án C
Trạng thái 1: V1 = ? ; p1 =l atm;
Trạng thái 2: V2 = 201 ; p2 = 25 atm.
Vì quá trình là đẳng nhiệt, nên ta áp dụng định luật Boyle- Mariotte cho hai trạng thái khí (1) và (2):
p1.V1 = p2.V2 ⇒ 1.V1 = 25.20 => V1 = 500 lít

+ Gọi v 0 là thể tích của bình
Ta xét trạng thái của lượng khí còn lại trong bình sau khi nhiệt độ tăng lên 127 độ C. Khi đó nó chiếm thể tích cả binh nhưng khi chưa mả van và nhiệt độ trong binh còn 27 độ C thì nó chiếm một phần hai thể tích cả bình.
Khi lượng khí đó ở nhiệt độ 27 ° C trạng thái 1


Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g
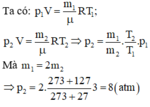
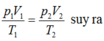
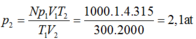
+ Áp dụng phương trình Menđêlêep- Clapêron: