Cho 11,36 gam P2O5 vào 200ml dung dịch NaOH 0,4M và Ba(OH)2 0,3M. Sau khi kết thúc phản ứng, thu được dung dịch X. Cô cạn dung dịch X thu được lượng rắn khan là:
A. 16,22
B. 13,52
C. 25,54
D. 20,54
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Gọi số mol các ion K+, HCO3-, Cl- và Ba2+ có trong 100 ml dung dịch lần lượt là x, y, z, t mol
-Phần 1: HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
t y t mol = 0,1 mol
-Phần 2:
HCO3-+ OH-→ CO32-+ H2O
y y y
Ba2++ CO32-→ BaCO3
y y = 0,15
-Phần 3:
Ag++ Cl-→ AgCl
2z 2z = 0,2 mol suy ra z = 0,1 mol
Theo ĐLBT ĐT thì: x+2t=y+z suy ra x=0,05 mol
đun sôi đến cạn 50 ml dung dịch X thì khối lượng chất rắn khan thu được là
(39x+ 61y + 35,5.z+ 137t)/2= 14,175 gam

Đáp án C
Nhận thấy sau 1 thời gian mới bắt đầu xuất hiện kết tủa → chứng tỏ trong dung dịch chứa H+ dư
Dựa vào đồ thị tại 17a mol OH- kết tủa không đổi → chỉ chứa Mg(OH)2 : 2a mol → nMg= 2a mol
Lượng kết tủa cực đại chứa Mg(OH)2 : 2a mol, Al(OH)3 : 3a mol → nAl2O3 = 1,5a mol
→ 2a. 24+ 1,5a . 102 = 12, 06 → a = 0,06 mol
Gọi số mol của HCl và H2SO4 lần lượt là0,5b và 0,1b
Dung dịch X chứa Mg2+ : 0,12 mol, Al3+ : 0,18 mol, Cl-:0,5b mol, SO42- :0,1b mol H+ dư : 0,7b- 0,78 ( bảo toàn điện tích)
Tại thời điểm 17a mol OH- thì nOH- = 4nAl3+ + 2nMg2+ + nH+ dư → 17. 0,06 = 4. 0,18 + 2.0,12 + 0,7b- 0,78 → b = 1,2
Khi thêm :
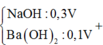


Kết tủa cực đại khi chưa ra sự hòa tan kết tủa thì nOH- = nH+ dư + 2nMg2+ + 3nAl3+ = 0,84
→ 0,5V = 0,84 → V = 1,68 lít → nBa2+ = 0,168 mol
Khi đó nBaSO4 = nSO42- = 0,12 mol
Chất rắn khan chứa BaSO4:0,12 mol; MgO: 0,12 mol; Al2O3: 0,09 mol → m = 41,94 gam

Đáp án C
Trong 100ml dd X có 0,1 mol Ba2+, 0,15 mol .
Trong 200ml dung dịch X có 0,2 mol Cl-.
Do đó trong 50 ml dung dịch X có 0,05 mol Ba2+, 0,075 mol , 0,05 mol Cl- và x mol K+
Theo định luật bảo toàn điện tích được x = 0,025
Khi cô cạn xảy ra quá trình:


Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Giải thích:
Dd X + NaOH → Mg(OH)2 + Al(OH)3
Lượng kết tủa khi NaOH dư là nMg(OH)2 = 2a
→ lượng kết tủa tối đa là nAl(OH)3 = n↓ - nMg(OH)2 = 5a - 2a =3a
→ nMg : nAl2O3 = 2a : = 4 : 3
Mà mhỗn hợp = 24nMg + 102nAl2O3 = 12,06 → nMg = 0,12 mol và nAl2O3 = 0,09 mol
→ a = 0,06 mol → nOH = 17a = 1,02 = nH+ (X) + 2nMg + 8nAl2O3 = nH+(X) + 0,96 → nH+(X) = 0,06 mol
Bảo toàn điện tích trong dung dịch X có nH+(X) + 2nMg2+ + 3nAl3+ = nCl- + 2nSO4 = 0,84
Mà nCl : nSO4 = 5 : 1 nên nCl- = 0,6 mol và nSO4 = 0,12 mol
X có Cl- : 0,6 mol SO42- : 0,12 mol, H+ : 0,06 mol, Al3+ : 0,18 mol và Mg2+ : 012 mol
Dd thêm vào có Ba2+ : x mol, Na+ : 3x mol ; OH- : 5x mol
Để thu được kết tủa tối đa thì ta có tạo kết tủa Al(OH)3 và Mg(OH)2 tối đa
nOH- = 5x = 0,18.3 +0,12.2 =0,78 mol
Khi đó Ba2+ : 0,156 → nBaSO4= 0,12 → ↓ BaSO4 : 0,12 mol; Al(OH)3 : 0,18 mol; Mg(OH)2 : 0,12 mol
→ nung thu được 0,12 mol BaSO4; 0,09 mol Al2O3 và 0,12 mol MgO
→ m =41,94
Đáp án D
Đáp án C
Hướng dẫn giải:
Ta có : nP2O5= 0,08 mol ; nNaOH= 0,08 mol ; nBa(OH)2= 0,06 mol ; nOH-= 0,08 + 2.0,06= 0,2 mol
P2O5+ 3H2O → 2 H3PO4
0,08 0,16mol
Ta có T= nOH-/nH3PO4= 1,25 → 1 <T<2 → OH- tác dụng với H3PO4 theo phương trình :
OH-+ H3PO4 → H2PO4- + H2O
x x x mol
2OH-+ H3PO4 → HPO42-+ 2H2O
2y y y mol
Ta có: nOH-= x + 2y= 0,2 mol ; nH3PO4= x + y= 0,16 mol →x= 0,12 và y= 0,04
Cô cạn dung dịch X thu được chất rắn khan chứa 0,12 mol H2PO4- và 0,04 mol HPO42- ; 0,08 mol Na+ và 0,06 mol Ba2+ → mchất rắn khan= 0,12. 97+ 0,04.96+ 0,08.23 + 0,06.137=25,54 gam