Dung dịch X có chứa 0,23 gam ion Na+; 0,12 gam ion Mg2+; 0,355 gam ion Cl- và m gam ion SO42-. Số gam muối khan sẽ thu được khi cô cạn dung dịch X là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đề thiếu:
Dung dịch A chứa 0,23 gam ion Na+; 0,12 gam ion Mg2+; 0,355 gam ion Cl- và m gam ion SO42–. Số gam muối khan sẽ thu được khi cô cạn dung dịch A là:
Ta có dung dịch A có chứa 0,01 mol Na+; 0,005 mol Mg2+; 0,01 mol Cl-
Suy ra số mol SO42- là: 0,01.1+0,005.2 = 0,01.1 + 2.
⇒ = 0,005 (mol)
Khối lượng gốc sunfat là: 0,005.96 = 0,48 gam
Số gam muối khan thu được khi cô cạn dung dịch A là:
0,23 + 0,12 + 0,355 + 0,48 = 1,185 (gam)

\(n_{Na^+}=\dfrac{0,23}{23}=0,01\left(mol\right);n_{Mg^{2+}}=\dfrac{0,12}{24}=0,005\left(mol\right);n_{Cl^-}=\dfrac{0,355}{35,5}=0,01\left(mol\right)\)
Bảo toàn điện tích :
\(n_{SO_4^{2-}}=\dfrac{0,01+0,005.2-0,01}{2}=0,005\left(mol\right)\\ m_{muối}=0,23+0,12+0,355+0,005.96=1,185\left(gam\right)\)

Chọn đáp án B.
nNa+ = 0,23/23 = 0,01; nMg2+ = 0,48/24 = 0,02 và nSO42- = 0,96/96 = 0,01
BTĐT => n N O 3 - = 0,01 + 0,02 × 2– 0,01 × 2 =0,03 => m N O 3 - = 0,03 × 62 = 1,86 gam => Đáp án D đúng.
Đáp án A đúng vì BaCl2 dư => Toàn bộ S O 4 2 - kết tủa hết => mBaSO4 = 233 × 0,01 = 2,33 gam
Đáp án B sai vì nếu là Mg(NO3)2 thì n N O 3 - = 2 × 0,02 > 0,03
Đáp án C đúng vì mRắn khan = 0,23 + 0,48 + 0,96 + 1,86 = 3,53 gam.

Đáp án C
n N a 2 S O 4 = 0,02 mol; nNaCl=0,5 mol; nNa+= 0,02.2+0,5= 0,54 mol
[Na+]= 0,54/(0,117+0,171+0,212)= 1,08M

Câu 3 :
\(pH=-log\left[H^+\right]=-log\left(0.1\right)=1\)
Câu 4 :
Chứa các ion : H+ , Cl-
Câu 5 :
\(n_{NaOH}=n_{HCl}=0.02\cdot0.1=0.002\left(mol\right)\)
\(\Rightarrow x=\dfrac{0.002}{0.01}=0.2\left(M\right)\)
Câu 1 :
Bảo toàn điện tích :
\(n_{SO_4^{2-}}=\dfrac{0.2\cdot2+0.1-0.05}{2}=0.225\left(mol\right)\)
\(m_{Muối}=0.2\cdot64+0.1\cdot39+0.05\cdot35.5+0.225\cdot96=40.075\left(g\right)\)
Câu 2 :
\(\left[Na^+\right]=\dfrac{0.15\cdot0.5\cdot2+0.05\cdot1}{0.15+0.05}=1\left(M\right)\)

Đáp án A
Khi cho NaOH, hay Ca(OH)2 dư tác dụng 1/2 dd X, đều xảy ra phản ứng:
HCO3- + OH- → CO32- + H2O. (1)
Ca2+ + CO32- → CaCO3. (2)
Khi tác dụng Ca(OH)2 dư thì do Ca2+ và OH- dư nên n(↓ phần 2) = n(HCO3-) = 4 , 5 100 = 0,045 mol.
Khi tác dụng NaOH dư, do OH- dư nên HCO3- phản ứng hết. với n(HCO3-) = 0,045. Trong khi n(↓ phần 1) = 2 100 = 0,02 < 0,045
⇒ kết tủa tính theo Ca2+ với n(Ca2+) = n (↓ phần 1) = 0,02 mol.
Bảo toàn điện tích (trong 1/2 dd) → n(Na+) + 2n(Ca2+)= n(HCO3-) + n(Cl-)
=> n(Na+) = 0,045 + 0,035- 0,02.2= 0,04 mol
Khi đun sôi thu được muối chứa Na+( tính trong 1/2 dd):
2HCO3- → CO32- + CO2+ H2O
0,04 mol Na+; 0,02 mol Ca2+; 0,035 mol Cl-; 0 . 045 2 CO32-.
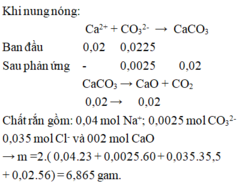
Khi nung nóng:
Ca2+ + CO32- → CaCO3
Ban đầu 0,02 0,0225
Sau phản ứng - 0,0025 0,02
CaCO3 → CaO + CO2
0,02 → 0,02
Chất rắn gồm: 0,04 mol Na+; 0,0025 mol CO32-; 0,035 mol Cl- và 002 mol CaO
→ m =2(0,04.23 + 0,0025.60 + 0,035.35,5 + 0,02.56) = 6,865 gam.

Đáp án A
Khi cho NaOH, hay Ca(OH)2 dư tác dụng 1/2 dd X, đều xảy ra phản ứng:
HCO3- + OH- → CO32- + H2O.(1)
Ca2+ + CO32- → CaCO3.(2)
Khi tác dụng Ca(OH)2 dư thì do Ca2+ và OH- dư nên n(↓ phần 2) = n(HCO3-) = 4,5/100= 0,045 mol.
Khi tác dụng NaOH dư, do OH- dư nên HCO3- phản ứng hết. với n(HCO3-) = 0,045. Trong khi n(↓ phần 1) = 2/100 = 0,02 < 0,045
⇒ kết tủa tính theo Ca2+ với n(Ca2+) = n(↓ phần 1) = 0,02 mol.
Bảo toàn điện tích ( trong 1/2 dd) → n(Na+) + 2n(Ca2+)=n(HCO3-) + n(Cl-)
=> n(Na+) = 0,045 + 0,035- 0,02.2= 0,04 mol
Khi đun sôi thu được muối chứa Na+( tính trong 1/2 dd): 2HCO3- → CO32- + CO2+ H2O
0,04 mol Na+; 0,02 mol Ca2+; 0,035 mol Cl-; 0,045/2 CO32-.
Khi nung nóng:
Ca2+ + CO32- → CaCO3
Ban đầu 0,02 0,0225
Sau phản ứng - 0,0025 0,02
CaCO3 → CaO + CO2
0,02 → 0,02
Chất rắn gồm: 0,04 mol Na+; 0,0025 mol CO32-; 0,035 mol Cl- và 002 mol CaO
→ m =2.( 0,04.23 + 0,0025.60 + 0,035.35,5 + 0,02.56) = 6,865 gam.



Đáp án A
Định luật bảo toàn điện tích suy ra
nSO4(2-)=(0,01.1+ 5.10-3.2- 0,01)/2=0,005 mol
Khối lượng muối khan thu được là: 0,23+ 0,12+ 0,355+ 0,005.96= 1,185 gam