Cho 18,5 gam hỗn hợp A gồm Fe, Fe3O4 tác dụng với 200ml dung dịch HNO3 a (mol/lít). Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí NO duy nhất (đktc), dung dịch B và 1,46 gam kim loại.Giá trị của a là
A. 3,2
B. 1,6
C. 2,4
D. 1,2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
![]()
Vì sau phản ứng còn dư kim loại nên trong dung dịch B tồn tại Fe(NO3)2. Các phản láng xảy ra:
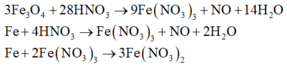
Như vậy trong toàn bộ các quá trình, số oxi hóa của sắt trong Fe và Fe3O4 đều về số oxi hóa +2.

Theo định luật bảo toàn mol electron, ta có:
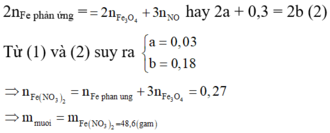

Định hướng tư duy giải
Tư duy đi tắt đòn đầu
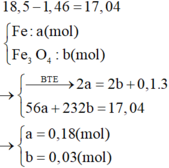
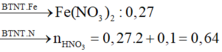
=> [HNO3] = 3,2 (M)

Khối lượng Fe dư là 1,46g, do đó khối lượng Fe và Fe3O4 đã phản ứng là 17,04g. Vì sau phản ứng sắt còn dư nên trong dung dịch D chỉ chứa muối sắt (II).
Sơ đồ phản ứng:
Fe, Fe3O4 + HNO3 → Fe(NO3)2 + NO + H2O
Mol: 2n+0,1 n 0,1 0,5( 2n+0,1)
Đặt số mol của Fe(NO3)2 là n, áp dụng định luật bảo toàn nguyên tố đối với nitơ ta có số mol của axit HNO3 là 2n+ 0,1. Số mol H2O bằng một nửa số mol của HNO3.
Áp dụng định luật bảo toàn khối lượng ta có:
17,04 + 63(2n + 0,1) = 242n + 0,1.30 + 18.0,5(2n + 0,1)
giải ra ta có n = 2,7, suy ra [ HNO3 ] = (2.2,7 + 0,1): 0,2 = 3,2M
Đáp án A

Chọn đáp án A
Quy đổi A về Fe và O, vì có kim loại chưa tan nên xem như Fe chỉ lên Fe+2
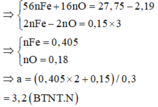

Đáp án A
Do Fe dư nên chỉ tạo ra Fe2+.
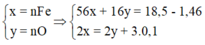
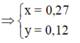
4H+ + NO3- + 3e → NO + 2H2O
2H+ + O + 2e → H2O
=> nHNO3 = nH+ = 4nNO + 2nO = 4.0,1 + 2.0,12 = 0,64
=> [HNO3] = 0,64/0,2 = 3,2M => Chọn A.
Đáp án A