Khử hoàn toàn 16 gam bột oxit sắt bằng khí CO ở nhiệt độ cao. Sau phản ứng khối lượng khí thu được tăng thêm so với khối lượng khí ban đầu 4,8 gam. Công thức của oxit sắt là
A. F e 2 O 3 .
B. FeO.
C. F e O 2 .
D. F e 3 O 4 .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Phản ứng của oxit + CO thực chất là:
CO + [O] → CO2
=> mchất rắn giảm = mO pứ = 4,8g => nO = 4,8 : 16 = 0,3 mol
=> mFe = mOxit – mO = 16 – 4,8 = 11,2 => nFe = 11,2 : 56 = 0,2 mol
=> nFe : nO = 0,2 : 0,3 = 2 : 3
=> Oxit là Fe2O3

mgiảm = mO(oxit) = 4.8 (g)
nO = 4.8/16 = 0.3 (mol)
nFexOy = 0.3/y (mol)
MFexOy = 16/0.3/y = 160y/3 (g/mol)
=> 56x + 16y = 160y/3
=> 56x = 112y/3
=> x / y = 2 / 3
CT : Fe2O3

a)
CTHH: FexOy
\(n_{Fe_xO_y}=\dfrac{16}{56x+16y}\left(mol\right)\)
PTHH: FexOy + yCO --to--> xFe + yCO2
\(\dfrac{16}{56x+16y}\)--------->\(\dfrac{16x}{56x+16y}\)
=> \(\dfrac{16x}{56x+16y}.56=16-4,8=11,2\)
=> \(\dfrac{x}{y}=\dfrac{2}{3}\Rightarrow Fe_2O_3\)
\(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3CO --to--> 2Fe + 3CO2
0,1------>0,3--------------->0,3
Ca(OH)2 + CO2 --> CaCO3 + H2O
0,3----->0,3
=> \(m_{CaCO_3}=0,3.100=30\left(g\right)\)
b) nCO (thực tế) = 0,3.110% = 0,33(mol)
=> VCO = 0,33.22,4 = 7,392(l)

a)
nCO2 = nCO = nO(bị khử)
Có \(m_{CO_2}-m_{CO}=4,8\)
=> \(44.n_{O\left(bị.khử\right)}-28.n_{O\left(bị.khử\right)}=4,8\)
=> nO(bị khử) = 0,3 (mol)
=> \(n_{Fe}=\dfrac{16-0,3.16}{56}=0,2\left(mol\right)\)
Xét nFe : nO = 0,2 : 0,3 = 2 : 3
=> CTHH: Fe2O3
b)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,2-->0,2--------------->0,2
=> V = 0,2.22,4 = 4,48 (l)
\(V_{dd.H_2SO_4}=\dfrac{0,2}{0,5}=0,4\left(l\right)\)
c) \(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,25}{1}>\dfrac{0,2}{1}\) => H2 hết, CuO dư
PTHH: CuO + H2 --to--> Cu + H2O
0,2<--0,2-------->0,2
=> a = (0,25-0,2).80 + 0,2.64 = 16,8 (g)

\(m_{tăng}=m_O=4,8\left(g\right)\\ \rightarrow n_{O\left(trong\text{ oxit}\right)}=\dfrac{4,8}{16}=0,3\left(mol\right)\\ \rightarrow n_{Fe\left(\text{trong oxit}\right)}=\dfrac{16-4,8}{56}=0,2\left(mol\right)\)
CTHH của oxit sắt: FexOy
=> x : y = 0,2 : 0,3 = 2 : 3
=> CTHH là Fe2O3
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\\ Mol:0,2\rightarrow0,2\\ \rightarrow V_{ddH_2SO_4}=\dfrac{0,2}{0,5}=0,4\left(l\right)=400\left(ml\right)\)

Đáp án C
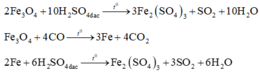
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
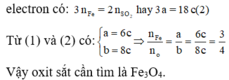

Đáp án C
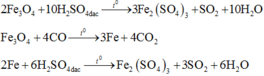
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:

