Cần bao nhiêu gam KMnO4 và bao nhiêu ml dung dịch axit clohiđric 1M để điều chế khí clo tác dụng với sắt, tạo nên 16,25g FeCl3?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Fe+ 3Cl2=(t0) 2FeCl3
nFeCl3=16,25/162,5=0,1 mol => nCl2=3/2nFeCl3=3/2.0,1=0,15 mol
2KMnO4+ 16HCl=2KCl+2MnCl2+5Cl2+8H2O
nKMnO4=2/5.nCl2=2/5. 0,15=0,06 mol --> mKMnO4=0.06. 158=9,48 g
nHCl=16/5. nCl2=16/5. 0,15=0,48 mol
--> VddHCl=0,48/ 1=0,48 lit= 480 ml

\(n_{FeCl_3}=\dfrac{16.25}{162.5}=0.1\left(mol\right)\)
\(Fe+\dfrac{3}{2}Cl_2\underrightarrow{t^0}FeCl_3\)
\(......0.15......0.1\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.06...............0.48........................................0.15\)
\(m_{KMnO_4}=0.06\cdot158=9.48\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{0.48}{1}=0.48\left(l\right)=480\left(ml\right)\)
\(2Fe+ 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = \dfrac{3}{2}n_{FeCl_3} = \dfrac{3}{2}.\dfrac{16,25}{162,5} = 0,15(mol)\\ 2KMnO_4 + 16HCl \to 2KCl + 2MnCl_2 + 5Cl_2 + 8H_2O\\ n_{KMnO_4} = \dfrac{2}{5}n_{Cl_2} = 0,06(mol)\\ \Rightarrow m_{KMnO_4} = 0,06.158 = 9,48(gam)\\ n_{HCl} = \dfrac{16}{4}n_{Cl_2} = 0,48(mol)\\ \Rightarrow V_{dd\ HCl} = \dfrac{0,48}{1} = 0,48(lít) = 480(ml)\)

2KMnO4 + 16HCl ---> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2Fe + 3Cl2 ---> 2FeCl3
Để điều chế đủ khí Clo thì số mol Cl2 = 3/2 số mol FeCl3 = 1,5.16,25/162,5 = 0,15 mol.
Số mol KMnO4 = 2/5 số mol Cl2 = 0,06 mol; m(KMnO4) = 0,06.158 = 9,48 g
V(HCl) = 0,48/1 = 480 ml.
KMnO4 + 16HCl ---> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2Fe + 3Cl2 ---> 2FeCl3
Để điều chế đủ khí Clo thì số mol Cl2 = 3/2 số mol FeCl3 = 1,5.16,25/162,5 = 0,15 mol.
Số mol KMnO4 = 2/5 số mol Cl2 = 0,06 mol; m(KMnO4) = 0,06.158 = 9,48 g
V(HCl) = 0,48/1 = 480 ml.

\(n_{Cl_2}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(2KMnO_4+16HCl_{\left(đ\right)}\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(0.2...................1.6...........................................0.5\)
\(m_{KMnO_4}=0.2\cdot158=31.6\left(g\right)\)
\(V_{dd_{HCl}}=\dfrac{1.6}{1}=1.6\left(l\right)=1600\left(ml\right)\)
\(n_{Cl_2}=\dfrac{11,2}{22,4}=0,5(mol)\\ PTHH:2KMnO_4+16HCl\to 2KCl+2MnCl_2+5Cl_2+8H_2O\\ \Rightarrow n_{KMnO_4}=\dfrac{2}{5}n_{Cl_2}=0,2(mol);n_{HCl}=\dfrac{16}{5}n_{Cl_2}=1,6(mol)\\ \Rightarrow m_{KMnO_4}=0,2.158=31,6(g);V_{dd_{HCl}}=\dfrac{1,6}{1}=1,6(l)=1600(ml)\)

2Fe + 3Cl2 --> 2FeCl3
16,25 gam FeCl3 tương đương với 0,1 mol FeCl3
Từ phương trình ta thấy để tạo ra được 0,1 mol FeCl3 thì số mol Cl2 dùng để phản ứng = 0.1.3/2 = 0,15 mol
Điều chế Clo: MnO2 + 4HCl --> MnCl2 + Cl2 + H2O
Mà để điều chế 0,15 mol Cl2 thì cần 0,15 mol MnO2 tức 0,15.87=13,05 gam MnO2 và 0,6 mol HCl => VHCl 1M = 0,6 lít

\(2KMnO_4+16HCl\rightarrow2MnCl_2+2KCl+5Cl_2+8H_2O\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
Ta có :
\(n_{FeCl3}=\frac{32,5}{56+35,5.3}=0,2\left(mol\right)\)
\(n_{Cl2}=\frac{3}{2}n_{FeCl3}=0,3\left(mol\right)\)
Theo phản ứng:
\(n_{KMnO4}=\frac{2}{5}n_{Cl2}=0,12\left(mol\right)\Rightarrow m_{KMnO4}=0,12.\left(39+55+16.4\right)=96\left(g\right)\)
\(n_{HCl}=\frac{16}{5}n_{Cl2}=0,96\left(mol\right)\)
\(\Rightarrow V_{HCl}=\frac{0,96}{1}=0,96\left(l\right)=960\left(ml\right)\)

\(n_{FeCl_3}=\dfrac{16,25}{162,5}=0,1\left(mol\right)\)
\(2Fe+3Cl_2\rightarrow2FeCl_3\)
0,1 0,15 0,1 (mol)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
0,06 0,48 0,15 (mol)
m\(_{KMnO_4}=0,06.158=9,48\left(g\right)\)
\(V_{HCl}=\dfrac{0,48}{1}=0,48\left(l\right)=480\left(ml\right)\)

Phương trình hóa học của phản ứng:
3Cl2 + 2Fe → 2FeCl3
Theo pt: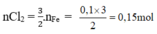
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Theo pt:
mKMnO4 cần = 0,06. 158 = 9,48g