Khi nhiệt độ trong một bình tăng cao, áp suất của khối khí trong bình cũng tăng lên đó là vì
A. Số lượng phân tử tăng
B. Phân tử khí chuyển động nhanh hơn
C. Phân tử va chạm với nhau nhiều hơn
D. Khoảng cách giữa các phân tử tăng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án: B
Khi chuyển động, mỗi phân tử khí va chạm với thành bình, bị phản xạ và truyền động lượng cho thành bình, rất nhiều phân tử va chạm với thành bình tạo nên một lực đẩy vào thành bình. Lực này tạo ra áp suất của khí lên thành bình. Do vậy khi nhiệt độ trong một bình tăng cao → chuyển động này càng nhanh → động lượng tăng nhanh → áp lực lên thành bình tăng → áp suất của khối khí trong bình cũng tăng lên.

Chọn C
Vì theo tính chất của chất khí khi tăng nhiệt độ thì vận tốc của các phân tử khí sẽ tăng.

ta có
\(\text{P1.V1=m/M.R.T (1) }\)
\(\text{P2.2V1=1/2.2m/M.R.T (2) }\)
lấy (1) chia (2) vế theo vế ta đc
\(\text{P1.V1/P2.2V1=1 }\)
\(\Rightarrow\text{P1.V1=P2.2V1 }\)
\(\Rightarrow\text{P1=2P2 }\)

Chọn B
Vì theo tính chất của chất khí khi nhiệt độ tăng thì vận tốc chuyển động động của các phân tử không khí tăng.

1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc:
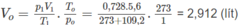
Số mol các chất trong bình trước phản ứng là:
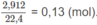
Số mol O2 = 0,1 (mol) ⇒ Số mol 2 ancol = 0,13 - 0,1 = 0,03 (mol).
Khi 2 ancol cháy :
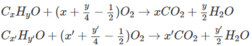
Số mol
H
2
O
là: 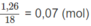
Số mol
C
O
2
là: 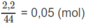
Theo định luật bảo toàn khối lượng :

= 3,2 + 0,03.16 - 0,07.16 - 0,05.32 = 0,96 (g).
Số mol
O
2
còn dư: 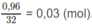
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là: V O = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
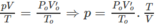
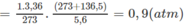
2. Giả sử C x H y O có PTK nhỏ hơn C x ' H y ' O ; như vậy số mol C x H y O sẽ là O 2 và số mol C x ' H y ' O là 0,01.
Số mol C O 2 sẽ là 0,02x + 0,01x' = 0,05 (mol) hay 2x + x' = 5.
x và x' là số nguyên: x = 1 ; x' = 3
hoặc x = 2; x' = 1
Cặp x = 2; x' = 1 loại vì trái với điều kiện: C x H y O có PTK nhỏ hơn C x ' H y ' O
Vậy, một ancol là C H 4 O và chất còn lại C 3 H y ' O .
Số mol H 2 O là 0,02.2 + 0,01.(y′/2) = 0,07 (mol).
⇒ y' = 6 ⇒ Ancol còn lại là C 3 H 6 O .
% về khối lượng của C H 4 O hay C H 3 - O H (ancol metylic) :

% về khối lượng của C 3 H 6 O hay C H 2 = C H - C H 2 - O H (a- Oncol anlylic): 100,00% - 52,46% = 47,54%.

Ta có: \(\overrightarrow{F}\cdot\Delta t=\Delta\overrightarrow{p}=\overrightarrow{p_{sau}}-\overrightarrow{p_{trc}}\)
\(\Rightarrow F\cdot\Delta t=6,54\cdot10^{-26}\cdot\left(-244-244\right)=-3,19152\cdot10^{-23}N\cdot s\)

a)
Cứ N A phân tử (nguyên tử) He có khối lượng 4g.
Chú ý: N = 3 , 01.10 23 = N A 2
⇒ khối lượng He trong bình: m = 4 2 = 2 g
b)
Trong điều kiện nhiệt độ và áp suất như trên (ĐKTC),
thể tích của 1 mol He là V 0 = 22,1 lít. Vì lượng khí He
trong bình chỉ là 0,5 mol nên thể tích của bình là:
V = V 0 2 = 11 , 2 lít.
Đáp án B
Khi nhiệt độ trong một bình tăng cao, áp suất của khối khí trong bình cũng tăng lên đó là vì phân tử khí chuyển động nhanh hơn