Lập phương trình phản ứng oxi hóa – khử sau đây theo phương pháp thăng bằng electron:
Cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

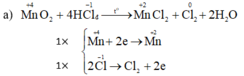

a) MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
| Mn+4 +2e-->Mn+2 | x1 |
| 2Cl-1 -2e--> Cl20 | x1 |
b) Cu + 4HNO3 --> Cu(NO3)2 + 2NO2 + 2H2O
| Cu0-2e-->Cu+2 | x1 |
| N+5+1e-->N+4 | x2 |
c) Mg + 2H2SO4 --> MgSO4 + SO2 + 2H2O
| Mg0-2e-->Mg+2 | x1 |
| S+6+2e-->S+4 | x1 |

Cân bằng các phản ứng oxi hóa – khử sau bằng phương pháp thăng bằng electron:
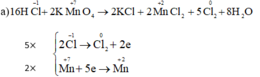
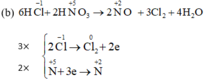
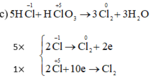
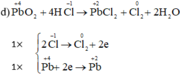
Tại sao chỉ tính oxi hóa của Cl2 mà ko tính oxi hóa của KCl vậy ạ?

Bài 2:
\(m_{HF}=\dfrac{2,5.40\%}{100\%}=1(kg)\\ \Rightarrow n_{HF}=\dfrac{1}{20}=0,05(kmol)\\ PTHH:CaF+H_2SO_4\to CaSO_4+2HF\\ \Rightarrow n_{CaF}=0,025(kmol)\\ \Rightarrow m_{CaF}=0,025.78=1,95(kg)\)
Bài 3:
\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases} \)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4(mol)\\ PTHH:2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ \Rightarrow \begin{cases} 56x+27y=11\\ x+1,5y=0,4 \end{cases} \Rightarrow \begin{cases} x=0,1(mol)\\ y=0,2(mol) \end{cases}\\ \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,1.56}{11}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=3n_{Al}+2n_{Fe}=0,2+0,6=0,7(mol)\\ \Rightarrow V_{dd_{HCl}}=\dfrac{0,7}{2}=0,35(l)\)