Cần bao nhiêu lít khí nitơ và khí hiđro để điều chế được 67,2 lit khí amoniac? Biết rằng thể tích của các khí đề được đo ở cùng điều kiện nhiệt độ, áp suất và hiệu suất của phản ứng là 25%?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn D
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ về thể tích cũng là tỉ lệ về số mol.
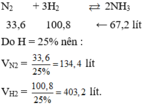

Khi hiệu suất đạt 25% thì được 67.2 lít
Theo lí thuyết sẽ là 100% hay khi đó =67,2 x 4=268.8 lit =12mol
N2 +3H2 =>2NH3
6<.......18<.......12
vN2 =6 x 22,4 =134.4lit
vH2 =1 x 22,4=403,2LIT

- Đáp án A
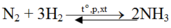
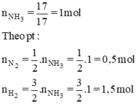
Do hiệu suất 25% nên
nN2cần dùng = 2( mol) và nH2cần dùng = 6(mol).
⇒VN2 = 2. 22,4 = 44,8 (lit) và VH2 = 22,4. 6= 134,4 (lit).

$n_{NH_3} = \dfrac{17}{17} = 1(mol)$
$N_2 + 3H_2 \xrightarrow{t^o} 2NH_3$
Theo PTHH :
$n_{N_2\ pư} = \dfrac{1}{2}n_{NH_3} = 0,5(mol)$
$n_{H_2\ pư} = \dfrac{3}{2}n_{NH_3} = 1,5(mol)$
Suy ra :
$n_{N_2\ đã\ dùng} = \dfrac{0,5}{25\%} = 2(mol)$
$n_{H_2\ đã\ dùng} = \dfrac{1,5}{25\%} = 6(mol)$
Vậy :
$V_{N_2} = 2.22,4 = 44,8(lít)$
$V_{H_2} = 6.22,4 = 134,4(lít)$
Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là: