Có một lượng khí trong bình. Nếu thể tích bình tăng gấp 4 lần, còn nhiệt độ giảm đi một nửa thì áp suất khí
A. giảm đi 4 lần
B. tăng lên 4 lần
C. tăng lên 8 lần
D. giảm đi 8 lần
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C.
Áp dụng phương trình trạng thái ta có:
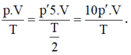
Do đó p' = p/10.

Chọn C.
Áp dụng phương trình trạng thái ta có:
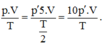
Do đó p’ = p/10.

Phương trình trạng thái khí lí tưởng: \(\dfrac{P.V}{T}=\text{const}\)
Suy ra: \(\dfrac{P_1.V_1}{T_1}=\dfrac{P_2.V_2}{T_2}\)
\(\Rightarrow T_2=\dfrac{P_2.V_2}{P_1.V_1}.T_1=\dfrac{7.10^5}{0,8.10^5.5}.(273+50)=565.25K\)
\(\Rightarrow t_2=565,25-273=292,25^0C\)

Chọn B.
Xét lượng khí còn lại trong bình:
Trạng thái 1: V1 = V/2; T1 = 300 K; p1 = 30 atm.
Trạng thái 2: V2 = V; T2 = 283 K; p2 = ?
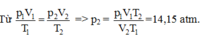

Áp suất lúc sau:
\(p_2=p_1-\Delta p\Rightarrow p_1=p_2+0,4\left(atm\right)\)
Quá trình đẳng nhiệt:
\(p_1V_1=p_2V_2\)
\(\Rightarrow\left(p_2+0,4\right)\cdot8=p_2\cdot10\)
\(\Rightarrow p_2=1,6atm\Rightarrow p_1=1,6+0,4=2atm\)
Chọn C

Đáp án B.
Ta có: Động lượng p = m.v;
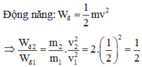
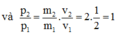
Suy ra động lượng không đổi, động năng giảm 2 lần.

Vì nhiệt độ không đổi nên độ tăng áp suất = độ tăng thể tích = độ tăng số mol.
2 NH3 --> N2 + 3 H2
Từ 1 mol NH3 ban đầu thì sau phản ứng thu 2 mol hỗn hợp sản phẩm.
Nếu a là số mol NH3 ban đầu thì sau khi phản ứng phân hủy kết thúc thu 1,5a mol sản phẩm tức là số mol tăng lên 0,5a mol.
Như vậy, đã có 0,5a/2 mol NH3 bị phân hủy.
Hiệu suất = 0,25a/a = 0,25 = 25%
Chọn A. 25%
Chọn D