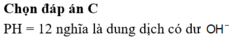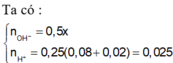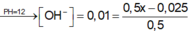Trộn 250 ml hỗn hợp HCl 0,08M và H2SO4 0,01M với 250ml đ Ba(OH)2 có nồng độ xM thu được m(g) kết tủa và 500ml đ có pH=12. Hãy tìm m và x.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam

nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam

:v
nH+ =0,25*0,08+0,25*0,01*2
nOH- ban đầu = 0,25*a*2
pH=12 => OH- dư
nOH- còn lại= 0,01*0,5
0,25*a*2-(0,25*0,08+0,25*0,01*2)=0,01*0,5
=> a=0,06
Bn tính m theo số mol của SO42- nha
m=(0,01*0,25)*233=0,5825

nBa(OH)2 = 0,25 x mol; nOH-= 0,5x mol
nH+ = 0,025 mol, nSO4(2-) = 0,0025 mol
H++ OH- → H2O
0,025 0,025 mol
Dung dịch sau phản ứng có pH = 12 nên OH- dư
nOH- dư = 0,5x- 0,025
[OH-] dư = nOH- dư/ Vdd = (0,5x- 0,025)/0,5 =10-2 suy ra a = 0,06 M
Ba2++ SO42- → BaSO4
0,015 0,0025 0,0025 mol
mBaSO4 = 0,5825 gam

Số mol HCl = 0,02 mol. Số mol H2SO4 = 0,0025 mol
=> Số mol H+ = 0,025 mol. Số mol SO42- = 0,0025 mol
Số mol Ba(OH)2 = 0,25x => số mol Ba2+ = 0,25 x và số mol OH- = 0,5x.
Vì sau Pứ pH của dung dịch = 7 => H+ và OH- pư vừa đủ
=> 0,025 = 0,5x => x = 0,05.
=> Ba2+ = 0,0125 mol
=> m = 0,0025. 233 = 0,5825g