Để hòa tan hết một mẫu Zn trong dung dịch axit HCl ở 20oC cần 27 phút , ở 40oC thì tan trong 3 phút . Vậy để mẫu dung dịch tan trong 55oC thì cần bao nhiêu thời gian
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Nhiệt độ tăng từ 20°C tới 40°C, tốc độ phàn ứng tăng 27/3 = 9 (lần)
Chú ý: Tốc độ phản ứng tỉ lệ nghịch với thời gian phản ứng.
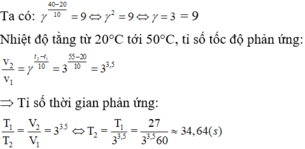

Đáp án D
Nhiệt độ tăng từ 20°C tới 40°C, tốc độ phàn ứng tăng 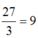 (lần)
(lần)
Chú ý: Tốc độ phản ứng tỉ lệ nghịch với thời gian phản ứng
Ta có: 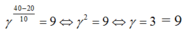
Nhiệt độ tằng từ 20°C tới 50°C, tỉ số tốc độ phản ứng:
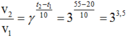
Þ Tỉ số thời gian phản ứng:
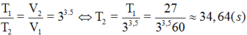

Đáp án A
Vì A và Z đều có hóa trị II khi tác dụng với dung dịch HCl nên gọi công thức chung


a) nHCl = 0,8.0,35 = 0,28 (mol)
mmuối = mKL + mCl = 3,64 + 0,28.35,5 = 13,58 (g)
b)
3,64 gam X phản ứng vừa đủ với 0,28 mol HCl
=> 3,64 gam X phản ứng vừa đủ với 0,28 mol H+
=> 1,82 gam X phản ứng vừa đủ với 0,14 mol H+
=> 1,82 gam X phản ứng vừa đủ với \(\dfrac{0,14}{2}=0,07\) mol H2SO4
mH2SO4 = 0,07.98 = 6,86 (g)
Cần thêm C% để tính m dung dịch nhé :)

Tiếp bài của creeper nhé:
c. Ta có: \(n_{ZnO}=\dfrac{4,86}{81}=0,06\left(mol\right)\)
Theo PT(1): \(n_{HCl}=2.n_{ZnO}=2.0,06=0,12\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{Zn}=2.0,1=0,2\left(mol\right)\)
=> \(n_{HCl}=0,12+0,2=0,32\left(mol\right)\)
=> \(m_{HCl}=0,32.36,5=11,68\left(g\right)\)
Ta có: \(C_{\%_{HCl}}=\dfrac{11,68}{m_{dd_{HCl}}}.100\%=12\%\)
=> \(m_{dd_{HCl}}=\dfrac{292}{3}\left(g\right)\)
Theo đề, ta có:
\(D=\dfrac{\dfrac{292}{3}}{V_{dd_{HCl}}}=1,2\)(g/ml)
=> \(V_{dd_{HCl}}=81,1\left(ml\right)\)

$NaOH + HCl \to NaCl + H_2O$
$n_{HCl\ dư} = n_{NaOH} = 0,05.2 = 0,1(mol)$
Gọi $n_{Fe} = a ; n_{Zn} = b \Rightarrow 56a + 65b = 12,1(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{HCl} = 2a + 2b = 0,5 -0,1 = 0,4(2)$
Từ (1)(2) suy ra a = b = 0,1
$\%m_{Fe} = \dfrac{0,1.56}{12,1}.100\% = 46,28\%$
$\%m_{Zn} = 100\% -46,28\% = 53,72\%$
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(HCl_{dư}+NaOH\rightarrow NaCl+H_2O\)
Gọi x, y lần lượt là số mol Fe, Zn, theo đề ta có:
\(\left\{{}\begin{matrix}56x+65y=12,1\\2x+2y=0,5.1-0,05.2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
=> \(\%m_{Fe}=\dfrac{0,1.56}{12,1}=46,28\%\)
=> \(\%m_{Zn}=100-46,28=53,72\%\)

Câu 5
\(S_{20^oC}=\dfrac{m_{K_2CO_3}}{m_{H_2O}}.100=112\left(g\right)\)
=> \(m_{K_2CO_3}=\dfrac{112.250}{100}=280\left(g\right)\)
Câu 6:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%\) (1)
\(C_M=\dfrac{n_{ct}}{V_{dd}}\) (2)
(1) => \(C\%=\dfrac{M_{ct}.n_{ct}}{1000.V_{dd}.D}.100\%\)
=> \(n_{ct}=\dfrac{C\%.1000.V_{dd}.D}{100\%.M_{ct}}=\dfrac{C\%.1000.V_{dd}.D}{M_{ct}}\)
=> \(C_M=\dfrac{n_{ct}}{V_{dd}}=\dfrac{\dfrac{C\%.1000.V_{dd}.D}{M_{ct}}}{V_{dd}}=\dfrac{C\%.1000.D}{M_{ct}}\)
tham khảo
Ta có: Lấy V lít hay 1000V ml dung dịch
=> Khối lượng dung dịch là: mdd = 100V. D
=> Khối lượng chất tan là: mctan=mdd100%.C%=1000V.D100%.C%=10V.D.C%mctan=mdd100%.C%=1000V.D100%.C%=10V.D.C%
=> Số mol của chất tan là: $$nctan=mctanM=10V.D.C%M$$nctan=mctanM=10V.D.C%M
Mà ta có:
CM=nctanV=10V.D.C%MV⇒CM=10.D.C%M(dpcm)
mik ko biết lm câu 1
Nhiệt độ tăng từ 20°C tới 40°C, tốc độ phàn ứng tăng 27/3 = 9 (lần)
Chú ý: Tốc độ phản ứng tỉ lệ nghịch với thời gian phản ứng.