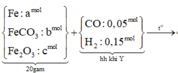
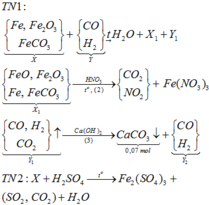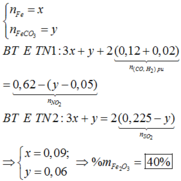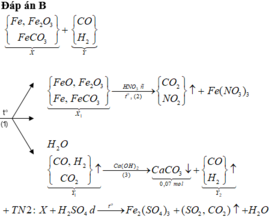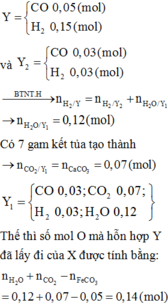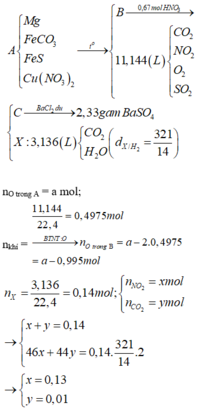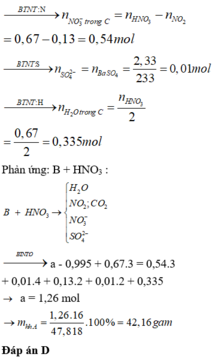Hỗn hợp A gồm 2 kim loại Mg, Cu tác dụng với H2SO4 đặc dư sau phản ứng thu được hỗn hợp 2 khí B có tỉ khối so với H2 là 24,5. Để hỗn hợp khí B trong một thời gian thu được 1 khí C duy nhất và kết tủa màu vàng. Sục khí C vào dung dịch Ca(OH)2 dư thu được 6 gam muối. Tính phần trăm khối lượng của kim loại.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
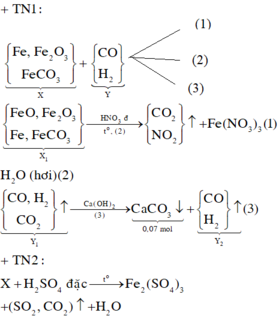
Sơ đồ quá trình phản ứng
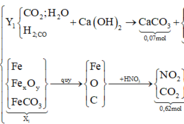

Hướng tư duy 1:
+ Xét khí Y1 có ![]()
![]()
+Xét hỗn hợp X1(sau khi quy đổi) có:
![]()
![]()
Do đó, trong 0,62 mol hỗn hợp khí có (0,67-b) mol NO (khí hóa nâu)
Bảo toàn nguyên tố Fe có:
![]()
= a + b = 2c mol
Bảo toàn O: ![]()
![]()
![]()
Bảo toàn e:
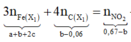
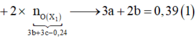
+ Xét hỗn hợp khí sau khi tác dụng H 2 S O 4 ta có:
![]()
![]()
Mà ![]()
=> giải hệ (1), (2), (3) ta được
![]()
Hướng tư duy 2:
Gọi x là số mol F e C O 3 bị nhiệt phân
Bảo toàn C ta có: ![]() = 0,05 mol
= 0,05 mol
=>
n
C
O
(
p
h
ả
n
ứ
n
g
)
= ![]()
![]()
+ Gọi a là số mol
F
e
C
O
3
phản ứng với
H
N
O
3
có ngay ![]()
+ Cho X phản ứng với H 2 S O 4 (đặc, nóng): (X chứa a+0,05 mol F e C O 3 )
Bảo toàn nguyên tố C có: ![]()
![]()
Bảo toàn e trong phản ứng với H N O 3 và H 2 S O 4 đặc nóng, có hệ:
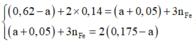
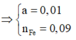
![]()
![]()

Bài 3 :
a) $Mg + H_2SO_4 \to MgSO_4 + H_2$
$n_{Mg} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$\%m_{Mg} = \dfrac{0,15.24}{13,2}.100\% = 27,27\%$
$\%m_{Cu} = 100\% -27,27\% = 72,73\%$
b) $n_{Cu} = \dfrac{13,2 - 0,15.24}{64}= 0,15(mol)$
$\Rightarrow m_{muối} = 0,15.120 + 0,15.160= 42(gam)$
Bài 4 :
Gọi $n_{Fe} = a(mol) ; n_{Mg} = b(mol)$
$56a + 24b = 18,4(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = a + b = \dfrac{11,2}{22,4} = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{18,4}.100\% = 60,87\%$
$\%m_{Mg} = 100\% -60,87\% = 39,13\%$
b) $n_{HCl} = 2n_{H_2} = 1(mol)$
$V_{dd\ HCl} = \dfrac{1}{0,8}= 1,25(lít)$