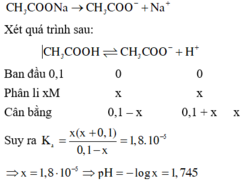Câu 1.
1. Tính tỷ số nồng độ mol/l của bazơ liên hợp và axit trong dung dịch đệm:
a. CH3COONa và CH3COOH có pH = 7
b. NaNO2 và HNO2 có pH = 2,95
2. Tính số gam CH3COONa cần thêm vào 500ml dung dịch CH3COOH 0,2M để được dung dịch có pH = 5
3. Tính số gam CH3COONa và thể tích dung dịch CH3COOH 5M cần dùng để được dung dịch 1 lít dung dịch đệm chứa 0,2 mol CH3COOH 0,1M và HCOOH xM. Xác định x để pH của dung dịch = 2,72.
Câu 2.
1. Tính độ điện lý của dung dịch CH3NH2 0,01M. Độ điện ly thay đổi như thế nào khi
- Pha loãng dung dịch 50 lần.
- Khi có mặt NaOH 0,001M.
- Khi có mặt CH3COOH 0,001M.
- Khi có mặt HCOONa 1M.
2. Cho dung dịch H2S 0,1M. Biết Ka1 = 10-7 ; Ka2 = 1,3.10-13
a. Tính pH của dung dịch.
b. Tính nồng độ mol/l của các ion HS-, S2- trong dung dịch.
Câu 3:
1. Cho các dung dịch sau: dung dịch A ( dung dịch NaHCO3); dung dịch B ( dung dịch NaH2PO4 ); dung dịch C ( dung dịch Na2HPO4). Hãy xét môi trường của 3 dung dịch này
Biết H2CO3 có Ka1 = 4,5.10-7; Ka2 = 4,8.10-11 và H3PO4 có K1 = 8.10-3, K2 = 6.10-8, K3 = 4.10-12
2. Xác định môi trường của dung dịch (NH4)2CO3.