Cho 15,6g kim loại Y(có hoá trị I không đổi) tác dụng với 11,2l hỗn hợp O2 và N2 có tỉ khối so với H2 là 15,2. Sau phản ứng thu được oxit của kim loại và hỗn hợp khí gồm O2 và N2 có tỉ khối so với H2 là 15. Xác định Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án : A
nX = 0,05 mol ; MX = 38,4g => nO2 = 0,03 ; nO3 = 0,02 mol
2Ag + O3 -> Ag2O + O2
2x <- x -> x (mol)
MY = 33,6g = (1,92 – 16x)/0,05 => x = 0,015 mol
=> a = mAg = 3,24g

Đáp án D
Có

m g X + HNO3 đặc nguội → 0,1 mol NO2
→ BTe a . n M = 0 , 1 m o l ( 2 )
Từ (1) và (2) suy ra:
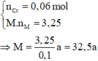
=> a = 2, M = 65 (M là Zn).

Đáp án C
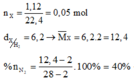
![]()
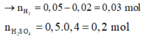
Vì sau phản ứng thu được hỗn hợp kim loại →H+ hết
Mg → Mg2+ + 2e
12H+ + 2NO−3 +10e → N2 + 6H2O
0,24 ← 0,04 ← 0,2 ← 0,02 mol
2H+ + 2e → H2
0,06 ← 0,06 ← 0,03
Cu2+ + 2e → Cu
![]()
=> Sản phẩm có NH4NO3
n H + c ò n l ạ i = 0,4 - 0,3 = 0,1 mol
10H+ + NO−3 + 8e → NH+4 + 3H2O
0,1 → 0,01 → 0,08 mol
![]()
![]()
![]()
m M g p h ả n ứ n g = 0 , 195 . 24 = 4 , 68 g
=> m = 0,4 + 4,68 = 5,08 g
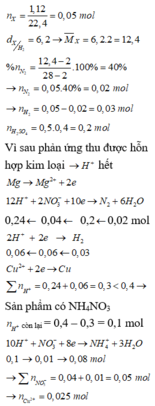
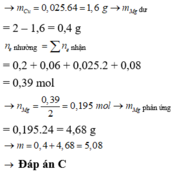




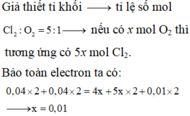
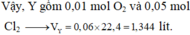
\(\overline{M_{bđ}}=15,2.2=30,4\)
\(n_{bđ}=\frac{1,12}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{O2}:a\left(mol\right)\\n_{N2}:b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,5\\\frac{32a+28b}{0,5}=30,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\overline{M_{dư}}=30\)
\(n_{O2\left(dư\right)}=x\left(mol\right)\)
\(\Rightarrow\frac{32x+28.0,2}{x+0,2}=30\)
\(\Rightarrow x=0,2\)
\(n_{O2\left(pư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(4Y+O_2\rightarrow2Y_2O\)
0,4____0,1______
\(\Rightarrow M_Y=\frac{15,6}{0,4}=39\left(K\right)\)