Cho 1 lượng sắt phản ứng hết với 24,5g axit sunfuric.
a)Hãy tính thể tích của khí H2 thoát ra ở đktc?
b)Tính khối lượng sắt đã tham gia phản ứng?
Mn ơi giúp em vs,em đang cần gấp lắm lắm lun ạ.
Các CTV và CTV tương lại ơi...Helpppp Meeee!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2SO4 = 14,7: 27=0,54(mol)
PTHH : 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
theo pt , nH2 = nH2SO4=0,54(mol)
=> VH2(đktc) = 0,54. 22,4=12,096 (l)
b theo pt nAl = 3/2. nH2=0,36 (mol)
=> mAl = 0,36.27 =9,72(g)
c)theo pt n Al2(SO4)3 = 1/2nAl = 0,18(mol)
=>mAl2(SO4)3= 0,18.342=61,56(g)

a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,15 0,3
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) ⇒ H2 pứ hết,Fe dư
\(V_{H_2}=3,36\left(l\right)\) (đề cho)
b, ko tính đc k/lg dd ,chỉ tính đc thể tích dd
\(V_{ddHCl}=\dfrac{0,2}{1}=0,2\left(l\right)=200\left(ml\right)\)

a)
\(n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\)
Phương trình hóa học : \(Fe + 2HCl \to FeCl_2 + H_2\)
Theo PTHH :
\(n_{HCl} = 2n_{H_2} = 0,3(mol)\\ n_{Fe} = n_{H_2} = 0,15(mol)\)
Vậy :
\(m_{HCl} = 0,3.36,5 = 10,95(gam) \\m_{Fe} = 0,15.56 = 8,4(gam)\)
b)
Bảo toàn khối lượng :
\(m_{Fe} + m_{HCl} = m_{FeCl_2} + m_{H_2} \\m_{FeCl_2} = 10,95 + 8,4 - 0,15.2 = 19,05(gam)\)
Fe + 2HCl-> FeCl2 + H2
theo phương trình:1 2 1 1 theo đề bài: 0,15 0,3 0,15 0,15 Số mol của H2: nH2=3,361:22,4≈0,15(mol) a)Khối lượng của các chất lần lượt là
mFe=0,15.56=8,4(g)mFe=0,15.56=8,4(g)
mHCl=0,3.36,5=10,95(g).mHCl=0,3.36,5=10,95(g).
b) Khối lượng của FeCl2: mFeCl2=0,15.127=19,059(g)

a)
\(n_{Fe} = \dfrac{14}{56} = 0,25(mol)\)
Phương trình hóa học : \(Fe + H_2SO_4 \to FeSO_4 + H_2\)
Theo PTHH : \(n_{H_2} = n_{Fe} = 0,25(mol)\\ \Rightarrow V_{H_2} = 0,25.22,4 = 5,6(lít)\)
b)
Có : \(n_{H_2SO_4} = n_{H_2} = 0,25(mol)\\ \Rightarrow m_{H_2SO_4} = 0,25.98 = 24,5(gam)\)

PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{H_2SO_4}=n_{Fe}=0,25\left(mol\right)\)
a, \(V_{H_2}=0,25.22,4=5,6\left(l\right)\)
b, \(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
Bạn tham khảo nhé!
nFe = \(\dfrac{14}{56}\)= 0,25 mol
Fe + H2SO4 → FeSO4 + H2
Theo pt : 1 1 1 1 mol
Theo đề bài : 0,25 0,25 0,25 0,25 mol
=> V H2 = 0,25 . 22,4 = 5,6 lít
mH2SO4 = 0,25 . 98 = 24,5 gam

a)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH :
$n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
b)
$n_{H_2SO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{H_2SO_4}} = \dfrac{0,15}{0,05} = 3M$
c)
$n_{FeSO_4} = n_{H_2} = 0,15(mol)$
$C_{M_{FeSO_4}} = \dfrac{0,15}{0,05} = 3M$

a) PTPU

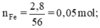
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (l)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)

\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.25....0.25.......................0.25\)
\(m_{Fe}=0.25\cdot56=14\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.25}{0.1}=2.5\left(M\right)\)
Em cảm ơn nhiều lắm lắm ạ.Thanksss.
:33