để điều chế oxi , người ta điện phân nước . Hãy tính khối lượng nước cần dùng để điều chế 224m3 O2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, Ta có: \(n_{CuO}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
PT: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
____0,03_0,015___0,03 (mol)
\(\Rightarrow m_{Cu}=0,03.64=1,92\left(g\right)\)
\(m_{O_2}=0,015.32=0,48\left(g\right)\)
b, \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Theo PT: \(n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,01\left(mol\right)\Rightarrow m_{KClO_3}=0,01.122,5=1,225\left(g\right)\)

a, Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
THeo PT: \(n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\Rightarrow V_{O_2}=0,04.22,4=0,896\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO_4}=2n_{O_2}=0,08\left(mol\right)\Rightarrow m_{KMnO_4}=0,08.158=12,64\left(g\right)\)
a) \(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02\left(mol\right)\).
PTHH : \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Mol : 3 : 2 : 1
Mol 0,04 ← 0,02
\(\Rightarrow V_{O_2}=n_{O_2}.22,4=\left(0,04\right).\left(22,4\right)=0,896\left(l\right)\).
b) Từ phương trình ở câu a \(\Rightarrow n_{O_2}=0,04\left(mol\right)\).
PTHH : \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Mol : 2 : 1 : 1 : 1
Mol : 0,08 ← 0,04
\(\Rightarrow m_{KMnO_4}=n_{KMnO_4}.M_{KMnO_4}=\left(0,08\right).158=12,64\left(g\right)\).

2KClO3 -> 2KCl + 3O2
a.nO2 = 0.28125mol
=> nKClO3 = 0.1875mol
=> mKClO3 = 22.97g
b.nKCl = nKClO3 = 0.1875mol
=> mKCl = 13.97g
$a)PTHH:2KClO_3\xrightarrow{t^o}2KCl+3O_2$
$n_{O_2}=\dfrac{9}{32}=0,28125(mol)$
$\Rightarrow n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,1875(mol)$
$\Rightarrow m_{KClO_3}=0,1875.122,5=22,96875(g)$
$b)$ Theo PT: $n_{KCl}=n_{KClO_3}=0,1875(mol)$
$\Rightarrow m_{KCl}=0,1875.74,5=13,96875(g)$

nFe3O4 = 17.4/232 = 0.075 (mol)
3Fe + 2O2 -to-> Fe3O4
0.225__0.15_____0.075
mFe = 0.225*56=12.6 (g)
VO2 = 0.15*22.4 = 3.36 (l)
2KClO3 -to-> 2KCl + 3O2
0.1________________0.15
mKClO3 = 0.1*122.5 = 12.25 (g)

\(n_{O_2}=\dfrac{9.6}{32}=0.3\left(mol\right)\)
\(2KClO_3\underrightarrow{^{^{t^0}}}2KCl+3O_2\)
\(a.\)
\(n_{KClO_3}=n_{KCl}=\dfrac{2}{3}\cdot n_{O_2}=\dfrac{2}{3}\cdot0.3=0.2\left(mol\right)\)
\(m_{KClO_3}=0.2\cdot122.5=24.5\left(g\right)\)
\(b.\)
\(m_{KCl}=0.2\cdot74.5=14.9\left(g\right)\)
\(a,n_{O_2}=\dfrac{9,6}{32}=0,3(mol)\\ 2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\\ \Rightarrow n_{KClO_3}=\dfrac{2}{3}n_{O_2}=0,2(mol)\\ \Rightarrow m_{KClO_3}=0,2.122,5=24,5(g)\\ b,n_{KCl}=n_{KClO_3}=0,2(mol)\\ \Rightarrow m_{KCl}=0,2.74,5=14,9(g)\)

PTHH: 3Fe + \(2O_2\) --->\(Fe_3O_4\)
theo pt: 3_____2_____________1
theo đề: x______y_____________0.01
nFe3O4 là: 0.01mol
\Rightarrow nO2= 0.01*2/1=0.02 mol
VO2= 0.02*22.4=0.448l
b, PTHH : 2KMnO4 ----> K2MnO4 + MnO2 + O2
theo pt: 2__________1________1______1
theo đề: x___________________________0.02
=> n KMnO4= 0.02*2/1= 0.04 mol
=>mKMnO4= 0.04*158=6.32g
a. số mol của Fe3O4 là :
2.32 : 232 =0.01 mol
theo tỉ lệ mol ta có số mol của Fe là:
0.01 * 3 = 0.03 mol
khối lượng sắt là: 0.03*56=1.68g
số mol oxi là: 0.01*2=0.02mol
thể tích oxi là: 0.02*22.4= 0.448g
b. 2KMnO_4 ---> K2MnO4 + MnO2 + O2
---> nKMnO_4 = 2nO2 = 0,04 mol ---> mKMnO_4=0.04*158=6.32g
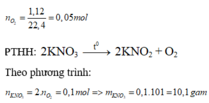
Ta có : \(V_{O_2}=224m^3=224000l\)
\(\Rightarrow n_{O_2}=\frac{224000}{22,4}=1000\left(mol\right)\)
PTHH : \(2H_2O\rightarrow2H_2\uparrow+O_2\uparrow\)
Theo phương trình : \(n_{H_2O}=2n_{O_2}\Rightarrow n_{H_2O}=2000\left(mol\right)\)
\(\Rightarrow m_{H_2O}=2000.18=36000\left(kg\right)\)