cho m gam kim loại R vào bình chứa dung dịch HCl dư , sau phản ứng thu được 0,672 lít khí hiđrô (ĐKTC) đồng thời khối lượng bình tăng thêm 4,05 gam
a) tìm m và xác định kim loại R
b) sau phản ứng phải cần 50 gam dung dịch Ca(OH)2 3,7% để trung hòa axit dư . Xác định nồng độ mol/lít của dung dịch HCl ban đầu

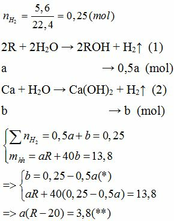
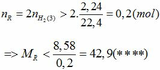
2R+2nHCl\(\rightarrow\)2RCln+nH2(1)
Ta có nH2=\(\frac{0,672}{22,4}\)=0,03(mol)
m tăng=mR-mH2
\(\rightarrow\)mR=4,05+0,03.2=4,11(g)
\(\rightarrow\)MR=4,11:0,06/n=68,5n
\(\rightarrow\)n=2 và MR=137
\(\rightarrow\)R là Bari
b) Ca(OH)2+2HCl\(\rightarrow\)CaCl2+2H2O(2)
nCa(OH)2=\(\frac{\text{50.3,7%}}{74}\)=0,025(mol)
nHCl=nHCl(1)+nHCl(2)=0,06+0,05=0,11(mol)