ở 20độ C độ tan tronh nc của Cu(NO3)2 * 6H2O là 125g . tính khối lượng của Cu(NO3)2 * 6H2O cần lấy để pha chế 450g đ bão hòa tính khối lượng Cu(NO3)2 VÀ C % của dd đó ở 20 độ C
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Cứ 125g Cu(NO3)2.6H2O --> 100g nước --> 225g dung dịch
250g <-- 200g <-- 450g
=> \(m_{Cu\left(NO_3\right)_2}\) = \(\dfrac{250.188}{296}\) = 158,784(g)
=> C% = \(\dfrac{158,784}{450}.100\%\) = 35,285%
Độ tan của \(Cu\left(NO_3\right)_2.6H_2O\) là 125 g .Nghĩa là 100 g H20 hoà tan 125g muối do đó khối lượng dung dịch là 225 g
125g muối trong 225 g dung dịch
x ( g).........................450 g dung dịch
-> x = 250 g
Cứ 296 muối ngậm nước có 188 g Cu(NO3)2
Vậy 250 g...................................... y g
\(C_{\%}=\dfrac{157,78}{450}.100=35,29\%\)

\(C\%_{bh}=\dfrac{125}{225}=\dfrac{\dfrac{m}{296}.188+100.0,3}{m+100}\\ m=321,132\left(g\right)\)

Đáp án B
Khi bọt khí bắt đầu thoát ra ở catot là thời điểm Ag+ và Cu2+ đều bị điện phân hết.
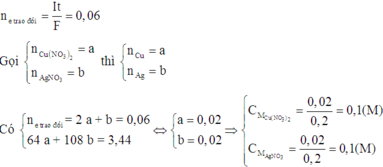

1.\(m_{BaCl_2}\) = 200.25% = 50g
2.\(C\%_{Cu\left(NO_3\right)_2}\) = \(\dfrac{40}{200}.100\) = \(20\%\)
3.Ở 25\(^o\)C 100g nước hòa tan được 36 g NaCl để tạo dung dịch bão hòa
\(m_{dd}=m_{ct}+m_{dm}=36+100=136g\)
Nồng độ phần trăm của dung dịch NaCl:C% = \(\dfrac{36}{136}.100=26,47\%\)
\(1,m_{BaCl_2}=\dfrac{200.25}{100}=50\left(g\right)\\ 2,C\%_{Cu\left(NO_3\right)_2}=\dfrac{4}{200}.100\%=20\%\\ 3,C\%=\dfrac{36}{36+100}.100\%=26,47\%\)

Đáp án C:
Gọi x, y là số mol Mg và Fe trong mỗi phần
=> 24x+56y = 4,32
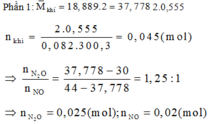

Phần 2: Gọi a, b lần lượt là số mol của AgNO3 và Cu(NO3)2
Sau phản ứng có 3 kim loại là Ag, Cu và Fe dư.
Gọi số mol Fe tham gia phản ứng là t (mol)
Bảo toàn electron ta có: nenhường= ne nhận
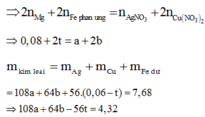
Chỉ có duy nhất Fe dư tan trong HCl
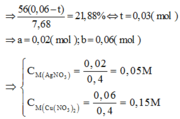

Giải thích các bước giải:
a Để tính nồng độ % của dung dịch CuSO4 bão hòa ở nhiệt độ trên, ta dùng công thức:
Nồng độ % = (Khối lượng chất tan/Công thức phân tử chất tan) / Thể tích dung dịch x 100%
Với dung dịch CuSO4 bão hòa ở 60 độ C, ta có:
Khối lượng chất tan (CuSO4) = 40 kg = 40000 g
Thể tích dung dịch = 100 ml = 100 cm^3
Công thức phân tử CuSO4: 1 Cu + 1 S + 4 O = 63.5 + 32 + 4 x 16 = 159.5
Nồng độ % = (40000/159.5) / 100 = 25.08 %
Vậy, nồng độ % của dung dịch CuSO4 bão hòa ở nhiệt độ 60 độ C là khoảng 25.08 %.
b) Để tính khối lượng H2O cần dùng để pha vào dung dịch trên và có được dung dịch CuSO4 10%, ta dùng công thức:
Khối lượng H2O = Khối lượng chất tan ban đầu - Khối lượng chất tan sau pha / (Nồng độ sau pha - Nồng độ ban đầu)
Giả sử khối lượng chất tan sau khi pha là x g (= 10/100 x khối lượng dung dịch sau khi pha)
Vậy, ta có:
Khối lượng chất tan sau pha = 32 g + x g
Nồng độ sau pha = 10%
Nồng độ ban đầu = 25.08 %
Ứng dụng công thức, ta có:
x = (32 - 0.1 x (32 + x)) / (0.100 - 0.2508)
10000 x = 32 - 0.1 x (32 + x)
10000 x = 32 - 3.2 - 0.1x^2
0.1x^2 - 9967.2x + 3.2 = 0
Giải phương trình trên bằng phương pháp giải phương trình bậc hai ta có:
x ≈ 0.3145 hoặc x ≈ 9965.88
Với x ≈ 0.3145, ta được khối lượng H2O ≈ 32 - 0.3145 = 31.6855 g
Vậy, để có được dung dịch CuSO4 10%, ta cần dùng khoảng 31.6855 g nước.

1)khối lượng dd sau điện phân \(=\frac{20\cdot100}{14,925}=134\)
=>khối lượng dd giảm sau điện phân= tổng khối lượng khí thoát ra =20+150-134=36
2H−−−−−>H2+2e
____________a___2a
2O−−+4e−−>O2
_________4b_____b
Ta có các hệ phương trình
\(\begin{cases}2a+32b=36\\2a-4b=0\end{cases}\)\(\Rightarrow\)\(\begin{cases}a=2\\b=1\end{cases}\)
sử dụng CT
\(n=\frac{PV}{RT}\Rightarrow V=\frac{4688}{65}\left(l\right)\)
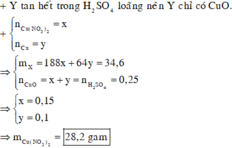
Ở 20oC
100 g nước ht 125g muối tạo thành 225 g dung dịch
Vậy xg nuoc ht y g muối tạo 450 g dd
--->y=\(\frac{450.125}{225}=250\left(g\right)\)
Cứ 296g Cu(NO3)2.6H2O có 188 g Cu(NO3)2
Vậy 250g .............................a g ................
-->m \(_{Cu\left(NO3\right)2}=\frac{250.188}{296}=158,78\left(g\right)\)
C%=\(\frac{158,78}{450}.100\%=35,28\%\)