Có hỗn hợp khí oxi và ozon. Sau một thời gian, khí ozon bị phân hủy hết, ta được một chất khí duy nhất có thể tích tăng thêm 2%.
Phương trình hóa học là: 2O3 → 3O2
a) Hãy giải thích sự gia tăng thể tích của hỗn hợp khí
b) Xác định thành phần phần trăm theo thể tích của hỗn hợp khí ban đầu. Biết các thể tích khí được đo cùng điều kiện nhiệt độ, áp suất
Giải giúp mik
đây là môn hóa học 10 ạ!

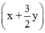 mol
mol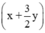 - (x + y) = 0,5y.
- (x + y) = 0,5y.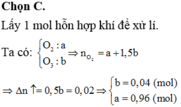


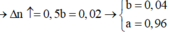
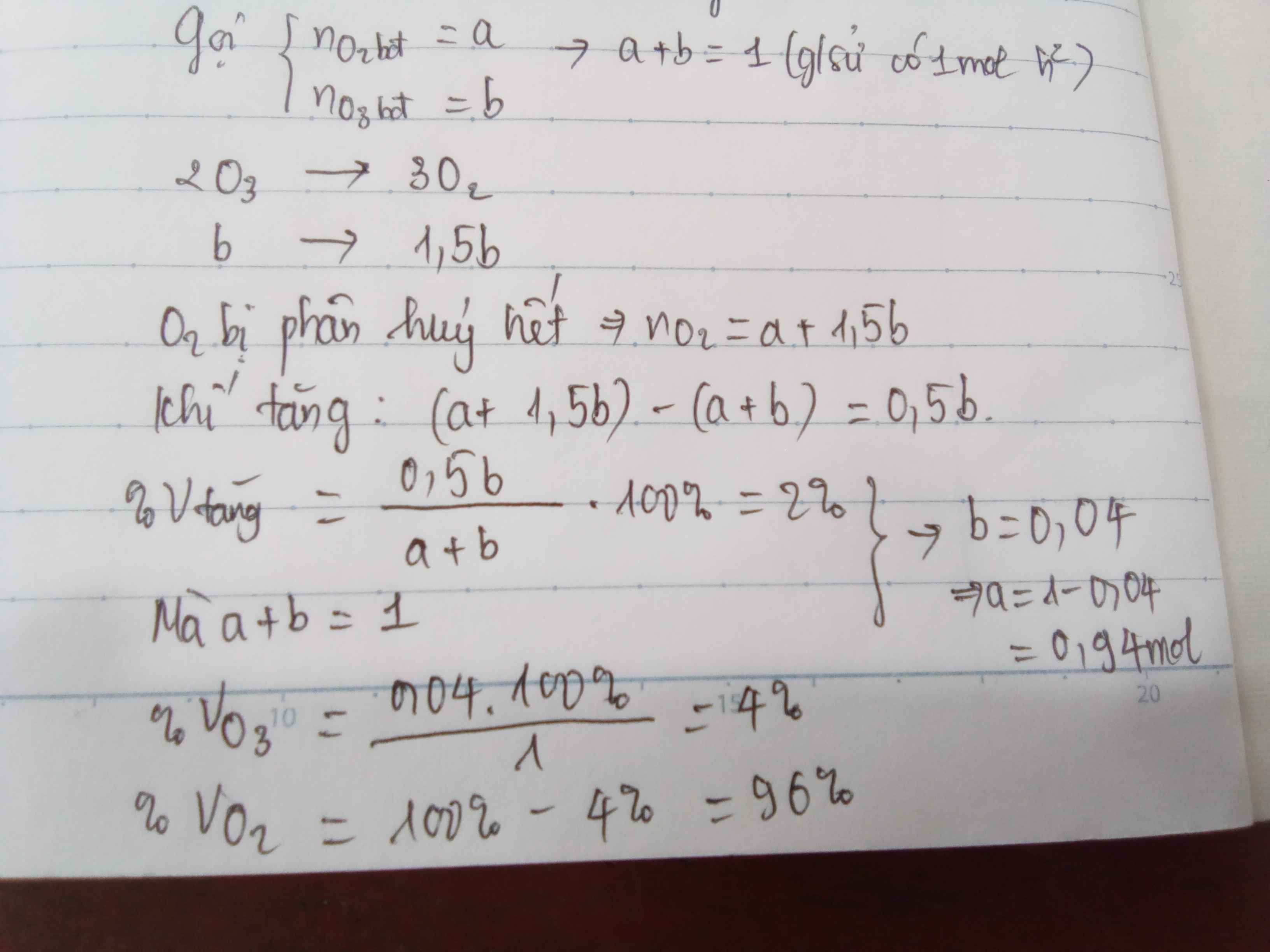
a) Ozon là khí kém bền nên sau một thời gian sẽ bị phân hủy theo PTHH: 2O3 -> 3O2
Vậy sự phân hủy của ozon khiến thể tích khí tăng lên.
b) Giả sử số mol của oxi và ozon trong hỗn hợp ban đầu là:
{nO2=x(mol)nO3=1(mol)2O3→3O21mol→1,5molnkhitang=1,5−1=0,5(mol)→0,5x+1.100%=2%→x=24(mol)→⎧⎨⎩%VO2=2424+1.100%=96%%VO3=100%−96%=4%
Đặt số mol O2 ban đầu và số mol O3 ban đầu lần lượt là a mol và b mol.
Xét 1 mol hỗn hợp ⇒a+b=1⇒a+b=1
2O3→3O2b→1,5b2O3→3O2b→1,5b
Vì O3 đã bị phân hủy hết nên sau phản ứng:
O2 (a + 1,5b) (mol)
Số mol khí tăng thêm: (a + 1,5b) – (a + b) = 0,5b mol
Theo đề bài:
%Vtăng thêm = 0,5b.100(a+b)=2⇒b=0,04⇒a=0,940,5b.100(a+b)=2⇒b=0,04⇒a=0,94
Thành phần phần trăm thể tích các khí trong hỗn hợp đầu
%VO3=0,04.1001=4%,%VO2=96%