Bài 2: Trong một bình kín thể tích 56 lít chứa hỗn hợp khí A gồm N2 và H2 theo tỉ lệ mol là 1:4 ở 0oC và 200 atm.Tính số mol khí của hỗn hợp A.Tính số mol mỗi khí có trong hỗn hợp ban đầu.Bài 3: Một hỗn hợp X gồm NH3 và O2 theo tỉ lệ mol 2:5 chiếm thể tích là 62,72 lít ở 0oC và 2,5 atm. Tính số mol NH3 và O2 trong hỗn hợp.Bài 4. Một hỗn hợp gồm O2, O3 ở điều kiện tiêu chuẩn có tỉ khối...
Đọc tiếp
Bài 2: Trong một bình kín thể tích 56 lít chứa hỗn hợp khí A gồm N2 và H2 theo tỉ lệ mol là 1:4 ở 0oC và 200 atm.
Tính số mol khí của hỗn hợp A.
Tính số mol mỗi khí có trong hỗn hợp ban đầu.
Bài 3: Một hỗn hợp X gồm NH3 và O2 theo tỉ lệ mol 2:5 chiếm thể tích là 62,72 lít ở 0oC và 2,5 atm. Tính số mol NH3 và O2 trong hỗn hợp.
Bài 4. Một hỗn hợp gồm O2, O3 ở điều kiện tiêu chuẩn có tỉ khối đối với hiđro là 18. Thành phần % về thể tích của O3 trong hỗn hợp là:
Bài 5. Tỉ khối hơi của N2 và H2 so vs O2 là 0,3125. Thành phần % thể tích của N2 trong hỗn hợp là bao nhiêu?
Bài 6. Để thu được dung dịch HCl 25% cần lấy m1 gam dung dịch HCl 45% pha với m2 gam dung dịch HCl 15%. Tỉ lệ m1/m2 là:
Bài 7: Để pha được 500 ml dung dịch nước muối sinh lí (C = 0,9%) cần lấy V ml dung dịch NaCl 3%. Giá trị của V là:
A. 150 | B. 214,3 | C. 285,7 | D. 350 |
Bài 8: Cho m (g) Fe tác dụng vừa đủ với 182,5g dung dịch HCl 10% thu dung dịch A và V lít khí H2 (ở đkc).
Tìm m, V?
Xác định khối lượng dung dịch A.
Tìm nồng độ phần trăm của dung dịch A thu được.
Bài 9: Cho m (g) Fe2O3 tác dụng vừa đủ với 400ml dung dịch HCl 1,5M thu được dung dịch A.
Xác định m.
Tìm nồng độ mol của dung dịch A, coi thể tích dung dịch thay đổi không đáng kể
Bài 10: Cho 13g kẽm tan hoàn toàn trong dung dịch HCl 20% vừa đủ thu được dung dịch X và V lít khí H2.
Viết phương trình phản ứng.
Tính nồng độ phần trăm của dung dịch A.

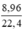 = 0,4 (mol)
= 0,4 (mol)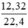 = 0,55 (mol)
= 0,55 (mol)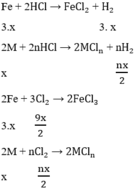
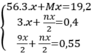
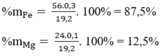
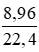 = 0,4 (mol)
= 0,4 (mol)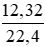 = 0,55 (mol)
= 0,55 (mol)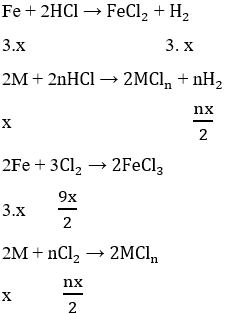
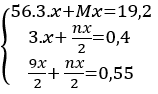

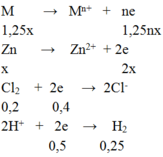
b, PTHH : H2 +Cl2---> 2HCl ( H= 75%)
--------------------20------>30
VHCl = (20.75)/100= 25l
Theo PTHH : vHCl = 30l
Hai ý còn lại chiuj