cho Br có hai đồng vị 79Br và 81Br , A=79,91
a) tính % khối lượng của 79Br trong NaBr;MgBr2;AlBr3
b) tính khối lượng Al2(SO4)3 tương ứng vs lượng AlBr3 (mol Al không đổi )biết có 18.1022 nguyên tử 81Br
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khối lượng nguyên tử trung bình của Br là
MBr = ( 79 . 54 , 5 + 81 ( 100 - 54 , 5 ) ) / 100 = 79 , 91

\(a.Đặt:\%^{79}Br=a\left(a>0\right)\\ \Rightarrow \%^{81}Br=100\%-a\\ \overline{NTK}_{Br}=79,91\\ \Leftrightarrow79a+81.\left(100\%-a\right)=79,91\\ \Leftrightarrow a=54,5\%\\ \Rightarrow\%^{79}Br=54,5\%;\%^{81}Br=45,5\%\)
b. Phần trăm theo KL đồng vị 79Br trong phân tử CaBr2:
\(54,5\%.\dfrac{70.91.2}{79,91.2+40}\approx43,59\%\)
c.
\(\left\{{}\begin{matrix}P=E\\P+N=79\\\left(P+E\right)-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P+N=79\\2P-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=35\\N=44\end{matrix}\right.\)

Đáp án D
%41K = 100 - 93,26 - 0,012 = 6,728%.
Khối lượng nguyên tử trung bình của K là:
MK = 39 x 0,9326 + 40 x 0,00012 + 41 x 0,06728 = 39,13468.
Khối lượng nguyên tử trung bình của Br là:
MBr = 79,92.
Thành phần phần trăm của 39K trong KBr là
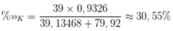
Brom có hai đồng vị , trong đó đồng vị 79Br chiếm 54,5% . Xác định đồng vị còn lại , biết M Br=79,91

\(\overline{A}=\dfrac{79.54,5\%+A_2.\left(100\%-54,5\%\right)}{100\%}=79,91\Rightarrow A_2=81\)
Đồng vị còn lại là : 81Br
a) Gọi x là % đồng vị 79Br
y là % đồng vị 81Br
Theo đề bài ta có: \(\left\{{}\begin{matrix}\frac{79x+81y}{100}=79,91\\x+y=100\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}79x+81y=7991\\x+y=100\end{matrix}\right.\)
<=> \(\left\{{}\begin{matrix}x=54,5\\y=45,5\end{matrix}\right.\)
Phần trăm khối lượng của 79Br trong NaBr là:
%m79Br = \(\frac{79.54,5\%}{79,91+22,989}.100\approx41,84\%\)
Phần trăm khối lượng của 79Br trong MgBr2 là:
%m79Br = \(\frac{79.2.54,5\%}{79,91.2+24,31}.100\approx46,766\%\)
Phần trăm khối lượng của 79Br trong AlBr3 là:
%m79Br = \(\frac{79.3.54,5\%}{79,91.3+26,98}.100\approx48,429\%\)