Sản xuất H2SO4 từ quạng birit Fe chứa 40% FeS2.Từ 80 kg quặng birit Fe sản xuất được bao nhiêu Kg Axit ?
Giúp mình nha
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_{Fe_2O_3}=1000000.60\%=600000(g)\\ \Rightarrow n_{Fe_2O_3}=\dfrac{600000}{160}=3750(mol)\\ PTHH:Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\\ \Rightarrow n_{Fe}=2n_{Fe_2O_3}=7500(mol)\\ \Rightarrow m_{Fe(\text {Phản ứng})}=7500.56=420000(g)\\ \Rightarrow m_{Fe(\text {Thực tế)}}=420000.80\%=336000(g)\\ \Rightarrow m_{gang}=\dfrac{336000}{95\%}\approx353684(g)=353,684(kg)\)

Đáp án C.
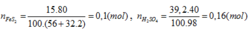
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Từ 120kg FeS2 có thể sản xuất đc bao nhiêu kg axit H2SO4 98%? Biết hiệu suất của cả quá trình là 80%

$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{1,6.98}{98\%} = 160(kg)$

\(m_{Fe_2O_3}=100000.80\%=80000(kg)\\ \Rightarrow n_{Fe_2O_3}=\dfrac{80000}{160}=500(kmol)\\ PTHH:Fe_2O_3+3CO\xrightarrow{t^o}2Fe+3CO_2\\ \Rightarrow n_{Fe}=2n_{Fe_2O_3}=1000(kmol)\\ \Rightarrow m_{Fe}=1000.56=56000(kg)\\ \Rightarrow m_{Fe(\text {Thực tế})}=56000.60\%=33600(kg)=33,6(tấn)\)

Khối lượng dung dịch H 2 SO 4 50% thu được :
100 tấn dung dịch có 50 tấn H 2 SO 4
x tấn ← 73,5 tấn
x = 73,5x100/50 = 147 tấn

Đổi 1,2 tấn = 1200 kg
Ta có: \(n_{FeS_2}=\dfrac{1200}{120}=10\left(kmol\right)\)
Bảo toàn Lưu huỳnh: \(n_{H_2SO_4\left(lý.thuyết\right)}=2n_{FeS_2}=20\left(kmol\right)\)
\(\Rightarrow m_{ddH_2SO_4\left(thực\right)}=\dfrac{20\cdot98}{50\%}\cdot80\%=3136\left(kg\right)=3,136\left(tấn\right)\)
4FeS2 + 11O2 \(\underrightarrow{to}\) 2Fe2O3 + 8SO2 (1)
2SO2 + O2 \(\underrightarrow{to}\) 2SO3 (2)
SO3 + H2O → H2SO4 (3)
\(m_{FeS_2}=80\times40\%=32\left(kg\right)=32000\left(g\right)\)
\(n_{FeS_2}=\frac{32000}{120}=\frac{800}{3}\left(mol\right)\)
Theo PT1: \(n_{SO_2}=2n_{FeS_2}=2\times\frac{800}{3}=\frac{1600}{3}\left(mol\right)\)
Theo PT2: \(n_{SO_3}=n_{SO_2}=\frac{1600}{3}\left(mol\right)\)
Theo PT3: \(n_{H_2SO_4}=n_{SO_3}=\frac{1600}{3}\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=\frac{1600}{3}\times98=52266,67\left(g\right)=52,26667\left(kg\right)\)
4FeS2 + 11O2 \(\underrightarrow{t^o}\) 2Fe2O3 + 8SO2 (a)
2SO2 + O2 \(\underrightarrow{t^o}\) 2SO3 (b)
SO3 + H2O \(\underrightarrow{t^o}\) H2SO4 (c)
\(m_{FeS_2}\) = 80 . 40% = 32 ( kg ) = 32000 ( g)
\(n_{FeS_2}\) = \(\dfrac{32000}{120}\) = \(\dfrac{800}{3}\) (mol )
Theo phương trình (a) có : \(n_{SO_2} = 2n_{FeS_2}= 2. \dfrac{800}{3} = \dfrac{1600}{3} ( mol )\)
Theo phương trình (b) có : \(n_{SO_3}= n_{SO_2} = \dfrac{1600}{3} (mol)\)
Theo phương trình (c) có : \(n_{H_2SO_4} = n_{SO_3} = \dfrac{1600}{3} (mol)\)
\(\rightarrow\) \(m_{H_2SO_4} = \dfrac{1600}{3} . 98 = 52266 , 67 (g) = 52 , 26667 (kg)\)