1. Dẫn 1,12 lít khí SO2 (đktc) vào 100ml dung dịch NaOH 1M, dung dịch thu đựoc chứa chất nào sau đây :
A. NaHSO3 B.NaHSO3 và Na2SO3 C. Na2SO3 và NaOH D.Na2SO3
2.Dung dịch nào sau đây không phản ứng với dung dịch AgNO3 :
A.BaCl2 B. HF C.NaCl D.NaBr
( Mọi nguời giúp mình với ah , giải thích càng tốt ạ :"")

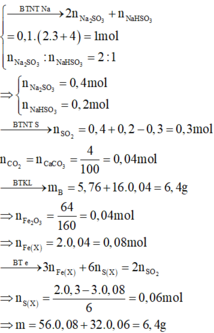
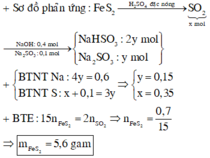
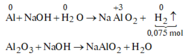
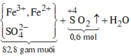
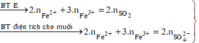
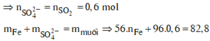
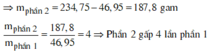
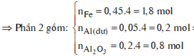
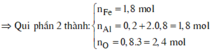
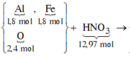
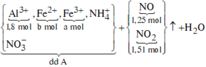
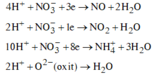
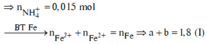

do nNaOH/nS02= 2--> sản phẩm chỉ tạo muối trung hòa ---> chọn D.
BaCl2+AgNO3-->AgCl(kết tủa trắng)+Ba(NO3)2;
AgNO3 +HF---> ko phản ứng
NaCl+AgNO3--> AgCl + NaNO3.
NaBr+AgNO3--> AgBr(kết tủa vàng nhạt) + NaNO3
chọn B