a) Cho 4,6 gam một kim loại M có hóa trị I tác dụng với lượng nước dư. Sau phản ứng thu được 2,24 lít khí H2 (ở đktc). Xác định kim loại M.
b) Cho 7,8 gam một kim loại X tác dụng hoàn toàn với lượng nước dư thì thu được 2,24 lít khí H2 (ở đktc). Xác định kim loại X.


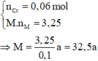






a/ M + H2O => MOH + 1/2 H2
nH2 = V/22.4 = 2.24/22.4 = 0.1 (mol)
Suy ra: nM = 0.2 (mol)
M = m/n = 4.6/0.2 = 23 (Na)
b/ Gọi hóa trị X là n
2X + 2nH2O => 2X(OH)n + nH2
nH2 = V/22.4 = 2.24/22.4 = 0.1 (mol)
===> nX = 0.2/n (mol)
X = m/n = 39n
Nếu n = 1 => X = 39 (K)
Nếu n =2 => X = 78 (loại)
a/
nH2= 2.24/22.4=0.1 mol
2M + 2nH2O --> 2M(OH)n + nH2
0.2/n____________________0.1
mM= 0.2n*M= 4.6
<=> 23n= M
Biện luận:
n= 1 => M= 23 (Na)
n=2 => M= 46 (l)
n=3 => M= 69 (l)
Vậy M là Na
2/
nH2= 2.24/22.4=0.1 mol
2X + 2nH2O --> 2X(OH)n + nH2
0.2/n____________________0.1
mX= 0.2n*M= 7.8
<=> X= 39n
Biện luận:
n= 1 => X= 39 (K)
n=2 => X= 78 (l)
n=3 => X= 117 (l)
Vậy: X à Kali