cho 1 lượng bột nhôm oxit tác dụng vừa đủ với 150ml dung dịch hcl 2M. dung dịch thu được đem tác dụng với v lít dung dịch naoh 2M thì thu được 5,85 gam kết tủa trắng dạng keo. tính v lít dung dịch naoh 0,2M đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{HCl}=\dfrac{200}{1000}.2=0,4\left(mol\right)\)
\(PTHH:Mg+2HCl--->MgCl_2+H_2\uparrow\left(1\right)\)
a. Theo PT(1): \(n_{Mg}=n_{H_2}=n_{MgCl_2}=\dfrac{1}{2}.n_{HCl}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,2.24=4,8\left(g\right)\\V_{H_2}=0,2.22,4=4,48\left(lít\right)\end{matrix}\right.\)
b. \(PTHH:2NaOH+MgCl_2--->Mg\left(OH\right)_2\downarrow+2NaCl\left(2\right)\)
Ta có: \(n_{NaOH}=\dfrac{\dfrac{20\%.100}{100\%}}{40}=0,5\left(mol\right)\)
Ta thấy: \(\dfrac{0,5}{2}>\dfrac{0,2}{1}\)
Vậy NaOH dư.
Theo PT(2): \(n_{Mg\left(OH\right)_2}=n_{MgCl_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Mg\left(OH\right)_2}=0,2.58=11,6\left(g\right)\)
a: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
200ml=0,2 lít
\(n_{HCl}=0.2\cdot22.4=4.48\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{H_2}=n_{H_2}\cdot M=2.24\cdot1=2.24\left(g\right)\)
\(n_{MgCl_2}=2.24\left(mol\right)\)
\(\Leftrightarrow n_{Mg}=2.24\left(mol\right)\)
\(\Leftrightarrow m_{Mg}=2.24\cdot24=53.76\left(g\right)\)

Đáp án D
► Bảo toàn electron: 3nAl = 2nH2 ⇒ nAl = 0,02 mol.
"vừa đủ" ⇒ X chỉ chứa AlCl3 || 0,09 mol hay 0,13 mol NaOH cho cùng 1 lượng ↓
⇒ 0,09 mol NaOH thì ↓ chưa đạt cực đại và 0,13 mol NaOH thì ↓ bị hòa tan 1 phần.
⇒ n↓ = 0,09 ÷ 3 = 0,03 mol. ||► Mặt khác, khi bị hòa tan 1 phần thì:
nOH– = 4nAl3+ – n↓ ⇒ nAl3+ = (0,03 + 0,13) ÷ 4 = 0,04 mol.
Bảo toàn nguyên tố Al: nAl2O3 = 0,01 mol ||⇒ m = 1,56(g)

Đáp án D
► Bảo toàn electron: 3nAl = 2nH2 ⇒ nAl = 0,02 mol.
"vừa đủ" ⇒ X chỉ chứa AlCl3 || 0,09 mol hay 0,13 mol NaOH cho cùng 1 lượng ↓
⇒ 0,09 mol NaOH thì ↓ chưa đạt cực đại và 0,13 mol NaOH thì ↓ bị hòa tan 1 phần.
⇒ n↓ = 0,09 ÷ 3 = 0,03 mol. ||► Mặt khác, khi bị hòa tan 1 phần thì:
nOH– = 4nAl3+ – n↓ ⇒ nAl3+ = (0,03 + 0,13) ÷ 4 = 0,04 mol.
Bảo toàn nguyên tố Al: nAl2O3 = 0,01 mol ||⇒ m = 1,56(g)

a, \(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
BT e, có: 3nFe = 2nSO2 ⇒ nSO2 = 0,45 (mol)
⇒ VSO2 = 0,45.22,4 = 10,08 (l)
b, BTNT Fe, có: nFe(OH)3 = nFe = 0,3 (mol)
⇒ mFe(OH)3 = 0,3.107 = 32,1 (g)

Đáp án B
Ta có:
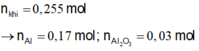
Dung dịch Y chứa 0,23 mol AlCl3.
Cho dung dịch chứa 0,3 mol Ba(OH)2 và 0,37 mol NaOH tác dụng với Y thu được dung dịch Z.
Z chứa Ba2+ 0,3 mol, Na+ 0,37 mol, AlO2- 0,23 mol, OH- dư 0,05 mol.
Cho H2SO4 vào Z.
Để kết tủa Al(OH)3 lớn nhất thì :
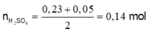
Để kết tủa BaSO4 lớn nhất thì : n H 2 S O 4 = 0 , 3 m o l
Lúc kết tủa BaSO4 tối đa thì Al(OH)3 bị hòa tan nhưng lượng BaSO4tạo thành lớn hơn Al(OH)3 bị hòa tan nên kết tủa vẫn tăng


Đáp án B
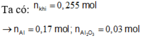
Dung dịch Y chứa 0,23 mol AlCl3.
Cho dung dịch chứa 0,3 mol Ba(OH)2 và 0,37 mol NaOH tác dụng với Y thu được dung dịch Z.
Z chứa Ba2+ 0,3 mol, Na+ 0,37 mol, AlO2- 0,23 mol, OH- dư 0,05 mol.
Cho H2SO4 vào Z.
Để kết tủa Al(OH)3 lớn nhất thì : n H 2 SO 4 = 0 , 23 + 0 , 05 2 = 0 , 14 mol
Để kết tủa BaSO4 lớn nhất thì : n H 2 SO 4
Lúc kết tủa BaSO4 tối đa thì Al(OH)3 bị hòa tan nhưng lượng BaSO4tạo thành lớn hơn Al(OH)3 bị hòa tan nên kết tủa vẫn tăng
→ V = 0 , 3 2 = 0,151 = 150 ml

Đáp án B
Ta có: n k h i = 0 , 255 m o l
![]()
Dung dịch Y chứa 0,23 mol AlCl3.
Cho dung dịch chứa 0,3 mol Ba(OH)2 và 0,37 mol NaOH tác dụng với Y thu được dung dịch Z.
Z chứa Ba2+ 0,3 mol, Na+ 0,37 mol, AlO2- 0,23 mol, OH- dư 0,05 mol.
Cho H2SO4 vào Z.
Để kết tủa Al(OH)3 lớn nhất thì :
n H 2 S O 4 = 0 , 23 + 0 , 05 2 = 0 , 14 m o l
Để kết tủa BaSO4 lớn nhất thì : n H 2 S O 4 = 0 , 3
Lúc kết tủa BaSO4 tối đa thì Al(OH)3 bị hòa tan nhưng lượng BaSO4tạo thành lớn hơn Al(OH)3 bị hòa tan nên kết tủa vẫn tăng
→ V = 0 , 3 2 = 150 m l

