cho 20 gam hổn hợp X gồm cuo và fe2o3 tác dụng vừa đủ với 0,2l dd hcl có nồng đọ 3,5M. Thành phần phần trăm theo khối lượng của cuo và fe2o3 trong hỗn hợp x lần lượt là:
a 30% và 70%
b 20% và 80%
c 22% và 78%
d 25% và 75%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Gọi a là số mol của CuO và b là số mol của F e 2 O 3 có trong 20 gam
hh 200 ml dd HCl 3,5 M => nHCl = 0,2 . 3,5 = 0,7 mol
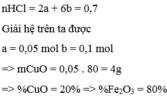

\(n_{HCl}=0,2.3,5=0,7\left(mol\right)\\ n_{CuO}=a;n_{Fe_2O_3}=b\\ CuO+2HCl\xrightarrow[]{}\Rightarrow CuCl_2+H_2O\\ Fe_2O_3+6HCl\xrightarrow[]{}2FeCl_3+H_2O\\ \left\{{}\begin{matrix}2a+6b=0,7\\80a+160b=20\end{matrix}\right.\\\Rightarrow a=0,05;b=0,1\\ \%_{CuO}=\dfrac{0,05.80}{20}\cdot100=20\%\\ \%_{Fe_2O_3}=\dfrac{0,1.160}{20}\cdot100=80\%\)

Đặt nCuO = x (mol) ; nFe2O3 = y (mol)
CuO + HCl -------> CuCl2 + H2O
x-------> x (mol)
Fe2O3 + 6HCl -------------> 2FeCl3 + 3H2O
y--------->6y (mol)
Theo đề bài ta có hệ
\(\left\{{}\begin{matrix}80x+160y=20\\x+6y=0,2.3,5\end{matrix}\right.\)
=> x = 0,025 (mol) ; y = 0,1125 (mol)
%mCuO = 0,025 . 80 .100% / 20 = 10 %
%mFe2O3 = 100 % - 10 % = 90 %

\(2Al+6HCl\to 2AlCl_3+3H_2\\ Fe+2HCl\to FeCl_2+H_2\\ n_{HCl}=0,2.4=0,8(mol)\\ \Rightarrow \begin{cases} 56.n_{Fe}+27.n_{Al}=22\\ 2.n_{Fe}+3.n_{Al}=0,8 \end{cases}\Rightarrow \begin{cases} n_{Fe}=0,39(mol)\\ n_{Al}=0,007(mol) \end{cases}\\ \Rightarrow \begin{cases} \%m_{Fe}=\dfrac{0,39.56}{22}.100\%=99,27\%\\ \%m_{Al}=100\%-99,27\%=0,73\% \end{cases}\)

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Giả sử: \(\left\{{}\begin{matrix}n_{Fe_2O_3}=x\left(mol\right)\\n_{CuO}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow160x+80y=40\left(1\right)\)
Ta có: \(n_{H_2}=\dfrac{14,56}{22,4}=0,65\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=3x+y\left(mol\right)\)
⇒ 3x + y = 0,65 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,15\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe_2O_3}=\dfrac{0,15.160}{40}.100\%=60\%\\\%m_{CuO}=40\%\end{matrix}\right.\)
Bạn tham khảo nhé!

a)
Phần 1 :
Gọi $n_{CuO} = a ; n_{Fe_2O_3} = b$
Ta có :
$80a + 160b = 80 : 2 = 40(1)$
$CuO + 2HCl \to CuCl_2 + H_2O$
$Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O$
Suy ra:
$135a + 162,5.2b = 78,5(2)$
Từ (1)(2) suy ra a = 0,1 ; b = 0,2
$\%m_{CuO} = \dfrac{0,1.80}{40}.100\% = 20\%$
$\%m_{Fe_2O_3} = 80\%$
b)
Dung dịch muối gồm :
$Fe^{3+} : 2b = 0,4(mol)$
$Cu^{2+} : a = 0,1(mol)$
$Cl^- : x(mol)$
$SO_4^{2-} : y(mol)$
Bảo toàn điện tích : 0,4.3 + 0,1.2 = x + 2y
$m_{muối} = 0,4.56 + 0,1.64 + 35,5x + 96y = 84,75$
Suy ra x = 0,9 ; y = 0,25
$C_{M_{HCl}} = \dfrac{0,9}{0,5} = 1,8M$
$C_{M_{H_2SO_4}} = \dfrac{0,25}{0,5} = 0,5M$

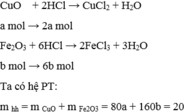
CuO+2HCl--->CuCl2+H2O
x 2x x x
Fe2O3+6HCl--->2FeCl3+3H2O
y 6y 2y 3y
nHCl=3,5.0,2=0,7 mol
gọi x y lần lượt là nCuO,nFe2O3
ta có x.80+y.160=20
2x+6y=0,7 giải hệ pt ta có x=0,05 y=0,1
mCuO=0,05.80=4g
mFe2O3=0,1.160=16g
%mCuO=4/20 .100%=20%
%mFe2O3=100%-20%=80%
b) 20 % và 80%
Gọi \(n_{CuO} và n_{Fe_2O_3} là x y\)
\(\begin{cases} 80x + 160y= 20\\ 2x+ 6y= 0,2 . 3,5=0,7 \end{cases} \)
x=0,05
y= 0,1
%\(m_{CuO}= \dfrac{0,05 . 80}{20} . 100\)%= 20%
=> %m\(Fe_2O_3\)= 80%