Cho 6,9 gam một kim loại kiềm vào 200ml dung dịch HCl thu được 3,36 lít khí H2 (dktc) và dung dịch X vào 100ml dung dịch AlCl3 1M thì thu được 5,46 gam kết tủa. Xác định kim loại kiềm và nồng độ mol của dung dịch HCl.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Khi cho kiềm vào dd axit thì axit p/ư tr
R+ HCl-----> RCl+ 1/2H2↑(1)
(Vì tạo kết tủa mà muối clorua k p/ư HCl=> kiềm R dư axit hết R p/ư với nc=>kết tủa là Al(OH)3 )
R(dư)+ H2O -----> ROH+ 1/2H2↑(2)
3ROH+ AlCl3 -----> 3RCl+ Al(OH)3↓(3)
nAl(OH)3=0.07 mol
nH2=0.15 mol
Theo(3) nROH=3nAl(OH)3=0.21 mol (*)
Theo(2) nH2=1/2nROH=1/2nR=0.105 mol
=>nH2(1)=0.15-0.105=0.045 mol
Theo(1) nR=nHCl=2 nH2=0.09 mol (**)
Do đó ΣnR=0.21(*)+0.09=0.3 mol
=>MR=6.9/0.3=23=> R là kiềm Na
(**)=>CmHCl=0.09/0.2=0.45M

nH2 = 0.115 (mol)
2A + 2nH2O => 2A(OH)n + nH2
0.23/n__________________0.115
MA = 8.97/0.23/n = 39n
BL : n = 1 => A = 39
A là : Kali
mKOH = 0.23*56 =12.88 (g)
mdd thu được = 8.97 + 100 - 0.115*2 = 108.74(g)
C% KOH = 12.88/108.74 *100% = 11.84(g)
c)
nCO2 = 3.36/22.4 = 0.15 (mol)
nKOH / nCO2 = 0.23/0.15 = 1.53
=> tạo ra 2 muối
Đặt :
nK2CO3 = a (mol)
nKHCO3 = b (mol)
2KOH + CO2 => K2CO3 + H2O
KOH + CO2 => KHCO3
nKOH = 2a + b = 0.23
nCO2 = a +b = 0.15
=>a = 0.08
b = 0.07
mK2CO3 = 0.08*138 = 11.04 (g)
mKHCO3 = 100* 0.07 = 7 (g)

nH2 = 3,36/22,4 = 0,15 (mol)
PTHH: 2R + 6HCl -> 2RCl3 + 3H2
nR = nRCl3 = 0,15 : 2/3 = 0,1 (mol)
M(R) = 2,7/0,1 = 27 (g/mol)
=> R là Al
CMAlCl3 = 0,1/0,2 = 0,5M
Ta có :
2Al + 6HCl ---> 2ACl3 + 3H2
nH2 = 0,15 mol
=> nAl = 0,1 mol
=> M = 2,7/0,1 = 27
=> ĐÓ là Al
nACl3 = 2/3nH2 = 0,1 mol
Cm = n/V = 0,1 / 0,2 = 0,5M

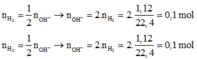

https://hoc24.vn/hoi-dap/question/640238.html