Cho 43,88g hỗn hợp Cu, Mg và Al tác dụng với dung dịch HCl dư thu được 26,88l H2 (đktc) và 20,48g kim loại không tan
a) Tính khối lượng hỗn hợp kim loại đã phản ứng
b) Tính khối lượng của các kim loại trong hỗn hợp ban đầu
c) Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp

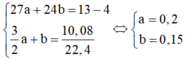

Mg+2HCl->MgCl2+H2
x x
2Al+6HCl->2AlCl3+3H2
y 3/2 y
mMg+mAl=23.4
->24x+27y=23.4
nH2=1.2(mol)
x+3/2 y=1.2
x=0.3(mol)->mMg=7.2(g)
y=0.6(mol)_>mAl=16.2(g)
Bạn tự tính % nhé :333
- Khối lượng không tan là Cu
\(\Rightarrow\) %Cu = \(\dfrac{20,48.100}{43,88}\) \(\approx\) 46,7%
\(\Rightarrow\) mhỗn hợp Mg và Al = 43,88 - 20,48 = 23,4 (g)
nH2 = 1,2 mol
Đặt nMg = x ( mol ); nAl = y ( mol ); ( x, y > 0 )
Mg + 2HCl \(\rightarrow\) MgCl2 + H2 (1)
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2 (2)
Từ (1)(2) ta có hệ pt
\(\left\{{}\begin{matrix}24x+27y=23,4\\x+1,5y=1,2\end{matrix}\right.\)
\(\Rightarrow\) \(\left\{{}\begin{matrix}x=0,3\\y=0,6\end{matrix}\right.\)
\(\Rightarrow\) %Mg = \(\dfrac{0,3.24.100}{43,88}\) \(\approx\) 16,4%
\(\Rightarrow\) %Al = \(\dfrac{0,6.27.100}{43,88}\) \(\approx\) 36,9%