Bài1 Hòa tan hoàn toàn 0,297 gam hỗn hợp Natri và một kim loại thuộc nhóm 2A trong bảng tuần hoàn các nguyên tố hóa học vào nước ta được dung dịch X và 56 ml khí Y( điều kiện tiêu chuẩn) xác định kim loại thuộc nhóm 2A và khối lượng của mỗi kim loại trong hỗn hợp.
Bài 2hỗn hợp x gồm 3 kim loại Al Fe Cu.
Cho m gam hỗn hợp X vào dung dịch CuSO4 dư sau phản ứng xảy ra hoàn toàn thu được 35,2 gam kim loại. Nếu cũng hòa tan M gam hỗn hợp X vào 500ml dung dịch HCl 2M đến khi phản ứng xảy ra hoàn toàn thu được 8,96 lít khí H2 dung dịch Y và a gam chất rắn khan
a viết phương trình phản ứng xảy ra và tìm giá trị của a
b cho từ từ NaOH 2M vào dung dịch Y vào Khuấy đều cho đến khi bắt đầu thấy kết tủa thì dùng hết V1 lít dung dịch NaOH 2M tiếp tục cho dung dịch NaOH 2M đến khi lượng kết tủa không thấy có sự thay đổi nữa thì lượng dung dịch NaOH 2M đã dùng hết 600 ml tìm giá trị m v

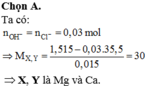
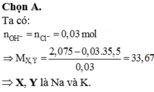
Bài 1:
Đạt kí hiệu và nguyên tử khối kim loại nhóm IIA chưa biết là M và a, b lần lượt là số mol Na và M trong hỗn hợp
Các phương trình phản ứng:
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\left(1\right)\)
\(a\left(mol\right)\rightarrow0,5a\left(mol\right)\)
\(M+2H_2O=M\left(OH\right)_2+H_2\uparrow\left(2\right)\)
\(b\left(mol\right)\rightarrow b\left(mol\right)\)
Theo bài cho ta có hệ phương trình toán học:
\(\left\{{}\begin{matrix}m_{hh}=m_{Na}+m_M=23a+Mb=0,297\left(I\right)\\n_{H_2}=0,5a+b=\dfrac{56}{22400}=0,0025mol\left(II\right)\end{matrix}\right.\)
\(\Leftrightarrow Từ\left(II\right)a=0,005-2b\) thế vào ( I) rồi rút gọn ta được:
\(b\left(M-46\right)=0,182hayb=\dfrac{0,182}{M-46}\left(III\right)\)
Điều kiện: \(0< b< 0,0025vàM>46\) thuộc nhóm IIA
Vậy M là Ba ( Bari )
Vì \(b=0,002\Rightarrow m_{Ba}=0,002.137=0,274g\)
Và \(m_{Na}=0,297-0,274=0,023gam\)
thanks