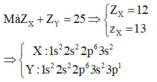Hai nguyên tố X và Y có tổng số proton là 18 trong đó số proton của X nhiều hơn số proton của Y là
4.
a) Viết cấu hình electron của X và Y.
b) Xác định lớp electron ngoài cùng của X và Y, X và Y là kim loại , phi kim hay khí hiếm.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
Ta có:p+e+n=116
Tức là :2p+n=116 (pt 1)
Số hạt mang điện trong ng tử là p và nên ta có p+e =2p
Số hạt không mang điện là n
Nên ta có 2p -n=24(pt2)
Từ 1,2 suy ra 2p+n=16
2p -n =24
Giải ra ta được:p=35,n=46
Số khối A=p+n =35+46=81
Ta có kí hiệu ngtu 81x35(xin lỗi mik ko ghi được)

Gọi tổng số hạt proton , electron , notron của 2 nguyên tử X và Y là M
gọi số proton , electron , notron của M lần lượt là p ,e ,n . TA CÓ :
p+e+n = 76 => 2p + n = 76 ( vì nguyên tử trung hòa về điện) (1)
do tổng số hạt mang điện tích lớn hơn tổng số hạt không mang điện tích là 24 hạt
=> 2p - n = 24
Kết hợp (1) ta được 2p = 50 => tổng số hạt mang điện tích của 2 nguyên tử X và Y là 50 hạt (*)
Từ đề ra ta lại có :
số hạt mang điện(Y) - số hạt mang điện(X) = 18(**)
Từ (*) và (**) => số hạt mang điện của Y = 34 (hạt) => Y có 17 proton => Y là nguyên tố Clo
=> số hạt mang điện của X = 16 (hạt) => X có 8 proton => X là nguyên tố Oxi

Kí hiệu : P X , P Y và N X , N Y lần lượt là số proton và số nơtron của nguyên tử X và Y.
Theo đề bài ta lập được hệ phương trình đại số :
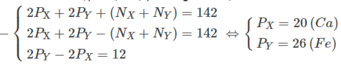

Đáp án B
Vì X và Y kế tiếp nhau trong một chu kì nên Z Y - Z X = 1
Mà 

Đáp án C
Vì X và Y thuộc cùng một nhóm A và ở chu kì liên tiếp nên ta có:
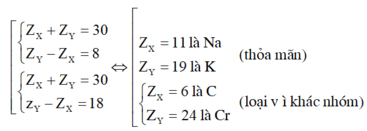
Khi đó cấu hình electron là của Na là 1s22s22p63s1

Đáp án C
Vì X và Y thuộc cùng một nhóm A và ở chu kì liên tiếp nên ta có:
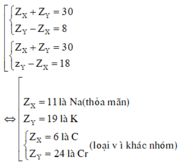
Khi đó cấu hình electron là của Na là 1s22s22p63s1.

B
Gọi số proton, nơtron và electron của X là p, n và e (trong đó p = e)
Theo bài ra ta có hệ phương trình:
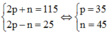
=> Cấu hình nguyên tử của X là
![]()