Bài 1 : Viết PTHH phản ứng cháy của các chất sau trong oxi : H2 , Mg , Cu , S ; Al ; C và P Bài 2: Cacbon cháy trong bình đựng khí oxi tạo thành khí cacbonic . Viết PTHH và tính khối lượng khí cacbonic sinh ra trong mỗi trường hợp sau a. Khi có 6,4 g khí oxi tham gia phản ứng b. Khi có 0,3 mol cacbon tham gia phản ứng c. Khi đốt 0,3 mol cacbon trong bình đựng 0,2 mol khí oxi Bài 3: Khi đốt khí metan ( CH4 ) ; khí axetilen (...
Đọc tiếp
Bài 1 : Viết PTHH phản ứng cháy của các chất sau trong oxi : H2 , Mg , Cu , S ; Al ; C và P
Bài 2: Cacbon cháy trong bình đựng khí oxi tạo thành khí cacbonic . Viết PTHH và tính khối lượng khí cacbonic sinh ra trong mỗi trường hợp sau
a. Khi có 6,4 g khí oxi tham gia phản ứng
b. Khi có 0,3 mol cacbon tham gia phản ứng
c. Khi đốt 0,3 mol cacbon trong bình đựng 0,2 mol khí oxi
Bài 3: Khi đốt khí metan ( CH4 ) ; khí axetilen ( C2H2 ) , rượu etylic ( C2H6O ) đều cho sản phẩm là khí cacbonic và hơi nước . Hãy viết PTHH phản ứng cháy của các phản ứng trên
Bài 4: Tính khối lượng oxi cần dùng để đốt cháy hết :
a. 46,5 gam photpho b. 30 gam cacbon
c. 67,5 gam nhôm d. 33,6 lít hidro
Bài 5: Người ta đốt cháy lưu huỳnh trong bình chứ 15g oxi . Sau phản ứng thu được 19,2 gam khí sunfuro ( SO2 )
a. Tính số gam lưu huỳnh đã cháy
b. Tính số gam oxi còn dư sau phản ứng cháy
Bài 6: Một bình phản ứng chứa 33,6 lít khí oxi (đktc) với thể tích này có thể đốt cháy :
a. Bao nhiêu gam cacbon ?
b. Bao nhiêu gam hidro
c. Bao nhiêu gam lưu huỳnh
d. Bao nhiêu gam photpho
Bài 7: Hãy cho biết 3 . 1024 phân tử oxi có thể tích là bao nhiêu lít ?
Bài 8: Tính thể tích oxi (đktc) cần dùng để đốt cháy hoàn toàn 1 kg than đá chứa 96% cacbon và 4% tạp chất không cháy
Bài 9: Đốt cháy 6,2 gam photpho trong bình chứa 6,72 khí lít oxi (đktc) tạo thành điphotpho pentaoxi
a. Chất nào còn dư sau phản ứng , với khối lượng là bao nhiêu ?
b. Tính khối lượng sản phẩm tạo thành

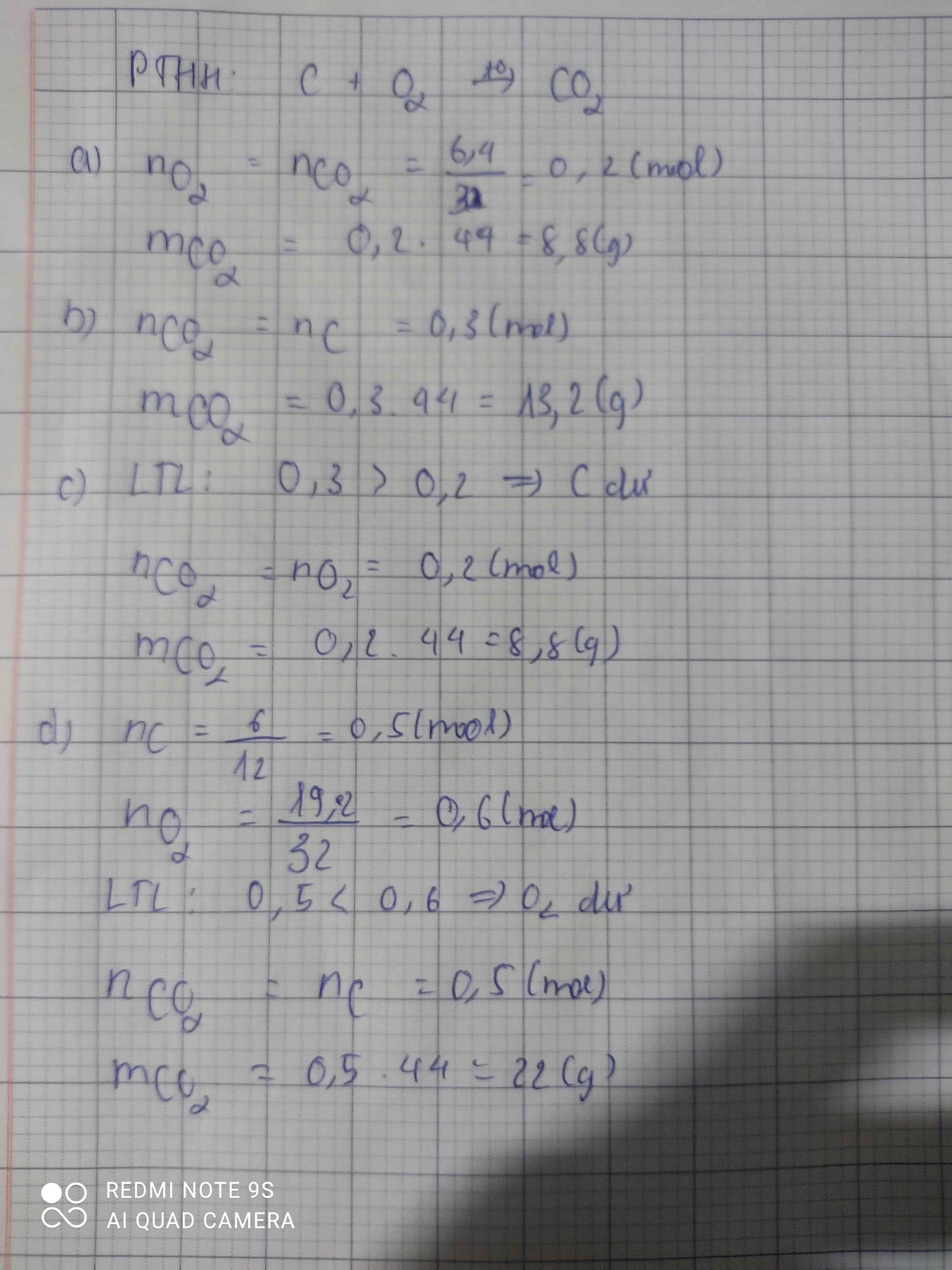
C + O2 -> CO2 (1)
a;
Từ 1:
nC=nCO2=0,2(mol)
mCO2=44.0,2=8,8(g)
b;
nC=0,3(mol)
Từ 1:
nC=nCO2=0,3(mol)
mCO2=44.0,3=13,2(g)
c;
nO2=0,2(mol)
Từ 1:
nO2=nCO2=0,2(mol)
mCO2=44.0,2=8,8(g)
a) \(C+O_2\underrightarrow{t^o}CO_2\)
\(m_{CO_2}=0,2\cdot44=8,8\left(g\right)\)
b)\(n_{CO_2}=\dfrac{3,6}{12}=0,3\left(mol\right)\\ C+O_2\underrightarrow{t^o}CO_2\\ m_{CO_2}=0,3\cdot44=13,2\left(g\right)\)
c)\(n_{O_2}=\dfrac{6,4}{32}=0,2\left(mol\right)\\ C+O_2\underrightarrow{t^o}CO_2\\ m_{CO_2}=0,2\cdot44=8,8\left(g\right)\)