Cho 200 gam dung dịch H2 SO4 19,6% vào 200g dịch bari clorua 5,2% a) tính khối lượng kết tủa thu được b) Tính nồng độ phần trăm của các chất trong dung dịch thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2SO_4}=\dfrac{200.19,6}{100.98}=0,4mol\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O\\ n_{CuSO_4\left(A\right)}=n_{CuO}=n_{H_2SO_4}=0,4mol\\ n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3mol\\ CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\\\Rightarrow\dfrac{0,4}{1}>\dfrac{0,3}{1}\Rightarrow CuSO_4.pư.không.hết\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
0,3mol 0,6mol 0,3mol
\(m_{ddB}=0,4.80+200+0,6.40-29,4=226,6g\\ C_{\%Na_2SO_4\left(B\right)}=\dfrac{0,3.142}{226,6}\cdot100=18,8\%\)

a/
\(n_{Na_2O}=\dfrac{9,3}{62}=0,15\left(mol\right)\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,15 0,3 (mol)
\(m_{NaOH}=0,3.40=12\left(g\right)\)
\(m_A=90,7+9,3=100\left(g\right)\)
\(C\%_{NaOH}=\dfrac{12}{100}.100\%=12\%\)
b/
m\(_{FeSO_4}=\dfrac{16.200}{100}=32\left(g\right)\)
\(\rightarrow m_{FeSO_4}=\dfrac{32}{152}=\dfrac{4}{19}\left(mol\right)\)
\(2NaOH+FeSO_4\rightarrow Na_2SO_4+Fe\left(OH\right)_2\downarrow\)
bđ: 0,3 \(\dfrac{4}{19}\) 0 0 (mol)
pư: 0,3 0,15 0,15 0,15 (mol)
dư: 0 \(\dfrac{23}{380}\) (mol)
\(m_{Fe\left(OH\right)_2}=0,15.90=13,5\left(g\right)\)
\(m_C=100+200-13,5=286,5\left(g\right)\)
\(m_{Na_2SO_4}=0,15.142=21,3\left(g\right)\)
\(\rightarrow C\%_{Na_2SO_4}=\dfrac{21,3}{286,5}.100\%\approx7,4\%\)
\(m_{FeSO_4\left(dư\right)}=\dfrac{23}{380}.152=9,2\left(g\right)\)
\(\rightarrow C\%_{FeSO_4\left(dư\right)}=\dfrac{9,2}{286,5}.100\%\approx3,2\%\)

Ta có: \(n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\)
\(n_{Cu\left(OH\right)_2}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Dung dịch A gồm: CuSO4 và H2SO4 dư
\(H_2SO_4+2NaOH\rightarrow Na_2SO_4+2H_2O\)
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2+Na_2SO_4\)
Đề có cho dữ kiện gì liên quan đến dd NaOH không bạn nhỉ?

a)
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
$n_{BaCl_2} = 0,1 < n_{H_2SO_4} = 0,2$ nên $H_2SO_4$ dư
$n_{BaSO_4} = n_{BaCl_2} = 0,1(mol)$
$m_{BaSO_4} = 0,1.233 = 23,3(gam)$
b)
A gồm :
$HCl : 0,1.2 = 0,2(mol)$
$H_2SO_4\ dư : 0,2 - 0,1 = 0,1(mol)$
$V_{dd} = 0,1 + 0,1= 0,2(lít)$
$C_{M_{HCl}} = \dfrac{0,2}{0,2} = 1M$
$C_{M_{H_2SO_4}} = \dfrac{0,1}{0,2} = 0,5M$
c)
$2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O$
$n_{NaOH} = 2n_{H_2SO_4\ dư} = 0,2(mol)$
$m_{dd\ NaOH} = \dfrac{0,2.40}{15\%} = 53,33(gam)$

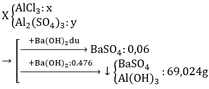
Cho Ba(OH)2 vào muối Al sẽ có 2TH sau:
TH1: kết tủa Al(OH)3 chưa bị hòa tan
Al3+ + 3OH– → Al(OH)3↓
→ nAl(OH)3 = nAl3+ → nAl(OH)3 = xn + 0,04n
TH2: kết tủa Al(OH)3 bị hòa tan một phần
Al3+ + 3OH– → Al(OH)3↓
(xn + 0,04n)→ 3(xn + 0,04n) (xn + 0,04n)
Al(OH)3 + OH– → AlO2– + 2H2O
0,952 – 3(xn + 0,04n) ←0,952
→ nAl(OH)3 = 4xn + 0,16n – 0,952


a)
Khối lượng của dung dịch:
\(m_{dd}=m_{ct}+m_{dm}=20+180=200\left(g\right)\)
Nồng độ phần trăm của dung dịch:
\(C\%=\dfrac{m_{ct}}{m_{dd}}.100\%=\dfrac{20}{200}.100\%=10\%\)
b) đề sai nha bạn

\(n_{KOH}=\dfrac{100.14}{100.56}=0,25(mol)\\ 2KOH+CuCl_2\to Cu(OH)_2\downarrow+2KCl\\ \Rightarrow n_{CuCl_2}=n_{Cu(OH)_2}=0,125(mol);n_{KCl}=0,25(mol)\\ a,m_{CuCl_2}=0,125.135=16,875(g)\\ b,m_{Cu(OH)_2}=0,125.98=12,25(g)\\ c,C\%_{KCl}=\dfrac{0,25.74,5}{100+16,875-12,25}.100\%=17,8\%\\ d,Cu(OH)_2\xrightarrow{t^o}CuO+H_2O\\ \Rightarrow n_{CuO}=0,125(mol)\\ \Rightarrow m_{CuO}=0,125.80=10(g)\)

\(m_{Fe_2\left(SO_4\right)_3}=\dfrac{200\cdot20}{100}=40\left(g\right)\Rightarrow n=0,1mol\)
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
0,1 0,6 0,2 0,3
a)\(m_{NaOH}=0,6\cdot40=24\left(g\right)\)
b)\(m_{Fe\left(OH\right)_3}=0,2\cdot107=21,4\left(g\right)\)
c)\(m_{Na_2SO_4}=0,3\cdot142=42,6\left(g\right)\)
\(m_{ddsau}=200+24-21,4=202,6\left(g\right)\)
\(\Rightarrow C\%=\dfrac{42,6}{202,6}\cdot100\%=21,03\%\)
\(m_{ct}=\dfrac{19,6.200}{100}=39,2\left(g\right)\)
\(n_{H2SO4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
\(m_{ct}=\dfrac{5,2.200}{100}=10,4\left(g\right)\)
\(n_{BaCl2}=\dfrac{10,4}{208}=0,05\left(mol\right)\)
Pt : \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4|\)
1 1 2 1
0,4 0,05 0,1 0,05
a) Lập tỉ số so sánh: \(\dfrac{0,4}{1}>\dfrac{0,05}{1}\)
⇒ H2SO4 dư , BaCl2 phản ứng hết
⇒ Tính toán dựa vào số mol của BaCl2
\(n_{BaSO4}=\dfrac{0,05.1}{1}=0,05\left(mol\right)\)
⇒ \(m_{BaSO4}=0,05.233=11,65\left(g\right)\)
b) \(n_{HCl}=\dfrac{0,05.2}{1}=0,1\left(mol\right)\)
⇒ \(m_{HCl}=0,1.36,5=3,65\left(g\right)\)
\(n_{H2SO4\left(dư\right)}=0,4-0,05=0,35\left(mol\right)\)
⇒ \(m_{H2SO4\left(dư\right)}=0,35.98=34,3\left(g\right)\)
\(m_{ddspu}=200+200-11,65=388,35\left(g\right)\)
\(C_{ddHCl}=\dfrac{3,65.100}{388,35}=0,94\)0/0
\(C_{ddH2SO4\left(dư\right)}=\dfrac{34,3.100}{388,35}=8,83\)0/0
Chúc bạn học tốt
\(a.n_{H_2SO_4}=\dfrac{200.19,6\%}{98}=0,4\left(mol\right)\\ n_{BaCl_2}=\dfrac{200.5,2\%}{208}=0,05\left(mol\right)\\ BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\\ Vì:\dfrac{0,05}{1}< \dfrac{0,4}{1}\\ \Rightarrow H_2SO_4dư\\ n_{BaSO_4}=n_{BaCl_2}=0,05\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{BaSO_4}=0,05.233=11,65\left(g\right)\\ b.m_{ddsau}=200+200-11,65=388,35\left(g\right)\\ C\%_{ddHCl}=\dfrac{0,05.2.36,5}{388,35}.100\approx0,94\%\\ C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{\left(0,4-0,05\right).98}{388,35}.100\approx8,832\%\)