1.Đốt cháy hoàn toàn 4,4g sunfua của 1 kim loại M (công thức MS) trong oxi dư.Chất rắn sau pứ đem hòa tan trong 1 lượng vừa đủ dd HNO3 37,8% thấy nồng độ % của muối trong dd thu được là 41,72%.Khi làm lạnh dd này thì thoát ra 8.08g muối rắn.Lọc tách muối rắn thấy nồng độ % của muối là 34,7%.Xác định công thức


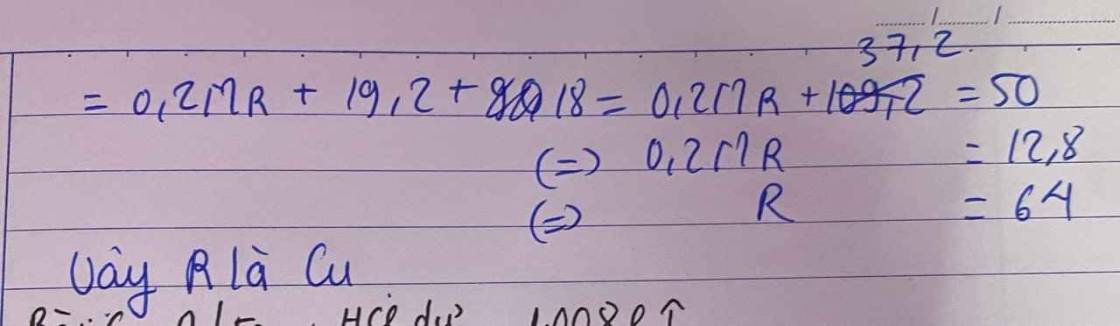
PTHH: 2 MS + (2+n/2) O2 → M2On + 2 SO2
a 0,5 a ( n là hóa trị cao nhất của M trong muối)
M2On + 2nHNO3 → 2M(NO3)n + nH2O
0,5a an a
Khối lượng dung dịch HNO3 là 63.an.100/ 37,8 = 500an/3 (g)
Khối lượng dung dịch sau phản ứng: aM + 8an + 500an/3.
Nồng độ muối: (aM + 62an) : (aM + 524an/3) = 0,4172.
→ M = 18,65.n → Với n=3, M=56 (Fe) là thỏa mãn.
Ta có a(M + 32) = 4,4 → a = 0,05 (mol)
Khối lượng Fe(NO3)3 = 0,05. 242 = 12,1 (g)
Khối lượng dung dịch sau khi muối kết tinh tách ra: aM + 524an/3 – 8,08 = 20,92 (g)
Khối lượng Fe(NO3)3 còn lại trong dung dịch: 20,92.34,7/100= 7,26 (g)
Khối lượng muối Fe(NO3)3 kết tinh là: 12,1-7,26 = 4,84.
Đặt công thức muối: Fe(NO3)3.mH2O → (4,84 : 242) . (242 + 18m) = 8,08 → m=9
Vậy công thức của muối kết tinh là : Fe(NO3)3.9H2O.