Hấp thụ hoàn toàn V(l) CO2 vào 237,36 gam dung dịch Ca(OH)2 25%. Sau phản ứng lọc tách kết tủa thu được dung dịch có khối lượng là 248,46 gam. Tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án D
Các chất trong X đều có CTPT là C4H8O2 và M = 88. nX = 0,075 mol.
Sơ đồ đốt: C4H8O2 → 4CO2 + 4H2O.
n C O 2 = n H 2 O = 4 n X = 0 , 3 m o l
m = 0,3.197 = 59,1 gam.
∆m = mdd sau = mdd trước = m2 - m1 = m C O 2 + m H 2 O – m
= 0,3.(44 + 18) – 59,1
= –40,5

Đáp án B
Gọi x là số mol CO2 (tương đương V lít).
Lúc cho V lít CO2 thu được x mol kết tủa CaCO3.
Cho cho V+3,36 lít CO2 vào thì chỉ thu được 2/3 lượng kết tủa tức 2x/3 mol CaCO3.
Vậy lượng 0,15 mol CO2 thêm vào đã tạo thêm một lượng kết tủa và hòa tan lượng kết tủa đó và hòa tan thêm x/3 mol kết tủa nữa
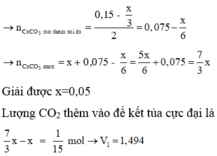

a)
Gọi $n_{CO_2} = a(mol)$
$Ba(OH)_2 + CO_2 \to BaCO_3 + H_2O$
Theo PTHH :
$n_{BaCO_3} = n_{CO_2} = a(mol)$
$\Rightarrow 197a - 44a = 1,53 \Rightarrow a = 0,01(mol)$
Suy ra :
$V = 0,01.22,4 = 0,224(lít)$
$m_{BaCO_3} = 0,01.197 = 1,97(gam)$
b)
$n_{Ba(OH)_2} = n_{CO_2} = 0,01(mol)$
$m_{Ba(OH)_2} = 0,01.171 = 1,71(gam)$

Đáp án A
Ta có: n C a C O 3 = 2/100 = 0,02 mol
mdung dịch tăng= m C O 2 - m C a C O 3
→ m C O 2 = 4,16 + 2 = 6,16 gam
→ n C O 2 = 0,14 mol
→ V C O 2 = 0,14.22,4 = 3,136 lít

\(n_{Ca\left(OH\right)_2}=\dfrac{237,36.25\%}{74}=0,8\left(mol\right)\)
Gọi x là số mol CO2 phản ứng
Ta có : \(n_{CaCO_3}=n_{CO_3^{2-}}=n_{OH^-}-n_{CO_2}=1,6-x\left(mol\right)\)
\(m_{ddsau}=m_{ddbd}+m_{CO_2}-m_{kếttua}\)
=> \(248,46=237,36+x.44+\left(1,6-x\right).100\)
=> x= 1,19
=> \(V=1,19.22,4=26,656\left(lít\right)\)