cho 1,97 gam Baco3 vào trong 300ml d d HCL 0,1M quấy dều. kết thúc phản ứng thấy thoát ra V lít khí ở đktc
a, Viết phương trình phản ứng sảy ra dạng phân tử và dang ion dút gọn
b, trong số các chất tham gia phản ứng chất nào còn dư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{BaCO_3}=\dfrac{1,97}{197}=0,01\left(mol\right);n_{HCl}=0,03\left(mol\right)\)
a)\(BaCO_3+2HCl\rightarrow BaCl_2+H_2O+CO_2\)
\(BaCO_3+2H^+\rightarrow Ba^{2+}+H_2O+CO_2\)
b)Lập tỉ lệ : \(\dfrac{0,01}{1}< \dfrac{0,03}{2}\) => HCl dư sau phản ứng
\(n_{CO_2}=n_{BaCO_3}=0,01\left(mol\right)\)
\(\Rightarrow V_{CO_2}=0,01.22,4=0,224\left(l\right)\)

Cho 0,87 gam hỗn hợp gồm Fe, Cu và Al vào dung dịch H2SO4
→ Chất rắn không tan là Cu, mCu= 0,32 gam, nCu=0,005 mol
2Al+ 3H2SO4 → Al2(SO4)3+ 3H2
Fe+ H2SO4 → FeSO4+ H2
Ta có mFe + mAl = 0,87 - 0,32 = 0,55 gam
Đặt nFe= x mol, nAl= y mol → 56x + 27y= 0,55
nH2= 1,5.x+ y= 0,448/22,4= 0,02 mol
=> x = 0,005; y= 0,01
ta có nH2SO4 ban đầu= 0,3.0,1=0,03 mol, nH2= 0,448/22,4=0,02 mol
nH+ còn lại = nH+ ban đầu- nH+ pứ= 2.nH2SO4- 2.nH2= 2. 0,03- 2.0,02= 0,02 mol
nNO3- =nNaNO3= 0,005 mol
Ta có các bán phản ứng sau
Fe2+ → Fe3+ + 1e
0,005 0,005
Cu -→ Cu2+ + 2e
0,005 0,01
=> ne cho = 0,015 mol= n e nhận
4H+ + NO3- + 3e → NO + 2H2O (3)
0,02 0,005 0,015 0,005
V = 0,005.22,4 = 0,112 lít
Theo bán phản ứng (3) thì cả H+ và NO3- đều hết
Khối lượng muối=Khối lượng kim loại + mNa+ + mSO4
= 0,87 + 0,005.23 + 0,03.96 = 3,865 gam
Đáp án D

a)
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
$4Al + 3O_2 \xrightarrow{t^o} 2Al_2O_3$
$2Na + 2HCl \to 2NaCl + H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
b)
Bảo toàn khối lượng : $m_{O_2} = 4,08 - 2,48 = 1,6(gam)$
$n_{O_2} = \dfrac{1,6}{32} = 0,05(mol)$
Đốt 2,48 gam X cần 0,05 mol $O_2$
Suy ra, đốt 4,96 gam X cần 0,1 mol $O_2$
Mà : \(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}=n_{O_2}=0,1\)
Theo PTHH :
\(n_{H_2}=\dfrac{1}{2}n_{Na}+n_{Mg}+\dfrac{3}{2}n_{Al}=2\left(\dfrac{1}{4}n_{Na}+\dfrac{1}{2}n_{Mg}+\dfrac{3}{4}n_{Al}\right)=2.0,1=0,2\)$V = 0,2.22,4 = 4,48(lít)$
$n_{HCl} = 2n_{H_2} = 0,4(mol)$
Bảo toàn khối lượng : $m = 4,96 + 0,4.36,5 - 0,2.2 = 19,16(gam)$

\(n_{H_2O}=\dfrac{2,4\cdot10^{23}}{6\cdot10^{23}}=0,4\left(mol\right)\\ n_{Ca}=\dfrac{m}{M}=\dfrac{4}{40}=0,1\left(mol\right)\\ PTHH:Ca+2H_2O->Ca\left(OH\right)_2+H_2\)
tỉ lệ 1 : 2 : 1 ; 1
n(mol) 0,1----->0,2--------->0,1--------->0,1
\(\dfrac{n_{Ca}}{1}< \dfrac{n_{H_2O}}{2}\left(\dfrac{0,1}{1}< \dfrac{0,4}{2}\right)\)
`=>` `Ca` hết, `H_2 O` dư, tính theo `Ca`
\(n_{H_2O\left(dư\right)}=0,4-0,2=0,2\left(mol\right)\)
\(m_{H_2O\left(dư\right)}=n\cdot M=0,2\cdot18=3,6\left(g\right)\\ V_{H_2\left(dktc\right)}=n\cdot22,4=0,1\cdot22,4=2,24\left(l\right)\\ m_{Ca\left(OH\right)_2}=n\cdot M=0,1\cdot74=7,4\left(g\right)\)
\(n_{Ca}=\dfrac{4}{40}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{2,4.10^{23}}{6.10^{23}}=0,4\left(mol\right)\)
PTHH :
\(Ca+2H_2O\rightarrow Ca\left(OH\right)_2+H_2\)
trc p/u: 0,1 0,4
p/u: 0,1 0,2 0,1 0,1
sau p/u: 0 0,2 0,1 0,1
-----> sau p/u : H2O dư
\(a,m_{H_2Odư}=0,2.18=3,6\left(g\right)\)
\(b,V_{H_2}=0,1.22,4=2,24\left(l\right)\)
\(c,m_{Ca\left(OH\right)_2}0,1.74=7,4\left(g\right)\)

\(n_{CuSO_4}=0,1.1=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{8,4}{56}=0,15\left(mol\right)\)
PTHH: Fe + CuSO4 --> FeSO4 + Cu
Xét tỉ lệ \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) => CuSO4 hết, Fe dư
PTHH: Fe + CuSO4 --> FeSO4 + Cu
_____0,1<---0,1---------->0,1
Fe + 2HCl --> FeCl2 + H2
0,05------------------->0,05
=> VH2 = 0,05.22,4 = 1,12(l)
b) \(C_{M\left(FeSO_4\right)}=\dfrac{0,1}{0,1}=1M\)

Chọn đáp án C
11,03 gam 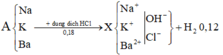
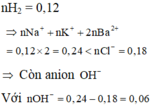
⇒ mRắn = 11,03+0,18.35,5+0,06.17 = 18,44 gam
\(a.BaCO_3+2HCl\rightarrow BaCO_3+CO_2+H_2O\\ CO_3^{2-}+2H^+\rightarrow CO_2+H_2O\\ b.n_{CO_3^{2-}}=n_{BaCO_3}=0,01\left(mol\right)\\ n_{H^+}=n_{HCl}=0,03\left(mol\right)\\ Vì:\dfrac{0,01}{1}< \dfrac{0,03}{2}\\ \Rightarrow HCldư\)