Cho hỗn hợp X gồm a mol Fe và 0,25 mol Mg vào dung dịch Y chứa Cu(NO3)2 và AgNO3 (tỉ lệ mol tương ứng 1 : 2). Sau khi các phản ứng kết thúc, thu được dung dịch Z và 61,6 gam chất rắn T gồm ba kim loại. Hòa tan toàn bộ T trong lượng dư dung dịch H2SO4 đặc nóng, thu được 0,55 mol SO2 (sản phẩm khử duy nhất của H2SO4). Tính giá trị của a.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
Do Al3+/Al > Fe2+/Fe > Cu2+/Cu > Fe3+/Fe2+ > Ag+/Ag ||⇒ Z gồm Fedư, Cu và Ag.
⇒ nFe dư = nH2 = 0,05 mol ||► Trong X có nAl = nFe = 8,3 ÷ (27 + 56) = 0,1 mol.
⇒ dung dịch sau phản ứng chứa 0,05 mol Fe(NO3)2 và 0,1 mol Al(NO3)3.
Đặt nCu(NO3)2 = x; nAgNO3 = y ⇒ ∑nNO3– = 2x + y = 0,05 × 2 + 0,1 × 3.
mrắn không tan = 64x + 108y = 28(g) ||⇒ Giải hệ có: x = 0,1 mol; y = 0,2 mol.
⇒ [Cu(NO3)2] = 1M; [AgNO3] = 2M ⇒ chọn B.

Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:

Đáp án A

Chọn đáp án A
Vì Z gồm 3 kim loại ⇒ Z gồm Ag, Cu, Fe.
+ Z phản ứng HCl dư ⇒ 0,05 mol H2 ⇒ nFedư = 0,05 mol
+ Sơ đồ bài toán ta có:
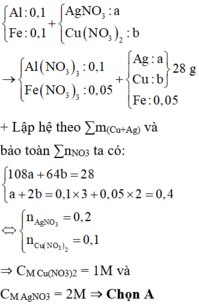

Đáp án D
Có

Nếu Cu(NO3)2 phản ứng hết: m Y ⩾ m Ag + m Cu = 108 . 0 , 09 + 64 . 0 , 135 = 18 , 36 g < 22 , 84 g
=> Cu(NO3)2 đã phản ứng hết, kim loại phản ứng còn dư, muối Fe tạo thành là Fe(NO3)2 (nếu Fe đã phản ứng).
mkim loại dư = 22,84 - 18,36 = 4,48 g
Đặt số mol Fe và Mg đã phản ứng lần lượt là x, y.
ü Trường hợp 1: Fe chưa phản ứng => y = 1 2 . n NaOH = 0 , 18 mol
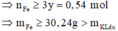
=> Loại
ü Trường hợp 2: Fe đã phản ứng → BTe n N a O H = 2 x + 2 y = 0 , 36 m o l
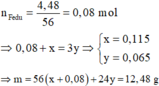

Đáp án D
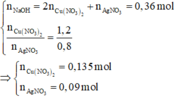
Nếu Cu(NO3)2 phản ứng hết:
m Y ⩾ m Ag + m Cu = 108 . 0 , 09 + 64 . 0 , 135 = 18 , 36 g < 22 , 84 g
=> Cu(NO3)2đã phản ứng hết, kim loại phản ứng còn dư, muối Fe tạo thành là Fe(NO3)2 (nếu Fe đã phản ứng)
m KL dư = 22 , 84 - 18 , 36 g = 4 , 48 g
Đặt số mol Fe và Mg đã phản ứng lần lượt là x, y.
ü Trường hợp 1: Fe chưa phản ứng ⇒ y = 1 2 n NaOH = 0 , 18 mol
![]()
=> Loại
ü Trường hợp 2: Fe đã phản ứng → BTe n N a O H = 2 x + 2 y = 0 , 36 m o l
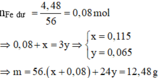

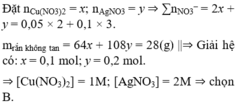

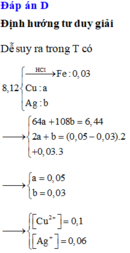
T gồm : $Cu(x\ mol) ; Ag(2x\ mol) ; Fe$ dư(y mol)
Suy ra: $64x + 108.2x + 56y = 61,6(1)$
$n_{Fe\ pư} = a - y(mol)$
Bảo toàn electron :
$(a- y).2 + 0,25.2 = 2x + 2x(2)$
$2x + 2x + 3y = 0,55.2(3)$
Từ (1)(2)(3) suy ra a = 0,25 ; x = 0,2 ; y = 0,1
T gồm 3 kim loại là Cu (x), Ag (2x) và Fe dư (y)
\(m_T=64x+108\cdot2x+56y=61.6\left(g\right)\left(1\right)\)
Bảo toàn e :
\(2x+2x+3y=0.55\cdot2\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
Bảo toàn electron:
\(2\cdot\left(a-0.1\right)+0.25\cdot2=2\cdot0.2+0.2\cdot2\)
\(\Rightarrow a=0.25\)