Một hỗn hợp gồm Fe2(SO4)3 và MgSO4, trong đó số nguyên tử oxi chiếm 32/ 47 tổng số nguyên tử có trong hỗn hợp. Tính phần trăm theo khối lượng mỗi chất trong hỗn hợp.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol FeSO4, Al2(SO4)3 là a, b (mol)
nFe = a (mol)
nAl = 2b (mol)
nS = a + 3b (mol)
nO = 4a + 12b (mol)
Có: \(\dfrac{n_O}{\Sigma n}=\dfrac{4a+12b}{a+2b+a+3b+4a+12b}=\dfrac{20}{29}\)
=> a = 2b
\(\left\{{}\begin{matrix}\%m_{FeSO_4}=\dfrac{152a}{152a+342b}.100\%=\dfrac{152.2b}{152.2b+342b}.100\%=47,059\%\\\%m_{Al_2\left(SO_4\right)_3}=100\%-47,059\%=52,941\%\end{matrix}\right.\)

a) Giả sử có 100 gam hỗn hợp
=> \(m_S=\dfrac{100.22,61}{100}=22,61\left(g\right)\)
=> \(n_S=\dfrac{22,61}{32}=\dfrac{2261}{3200}\left(mol\right)\)
Mà nO = 4nS
=> \(n_O=\dfrac{2261}{800}\left(mol\right)\)
\(\%m_O=\dfrac{\dfrac{2261}{800}.16}{100}.100\%=45,22\%\)
b)
\(n_{Fe}=\dfrac{18.10^{24}}{6.10^{23}}=30\left(mol\right)\)
=> \(n_{Fe_2\left(SO_4\right)_3}=15\left(mol\right)\)
Gọi số mol CuSO4 là x (mol)
=> mhh = 160x + 6000 (g)
nS = 15.3 + x = x + 45 (mol)
\(\%m_S=\dfrac{\left(x+45\right).32}{160x+6000}.100\%=22,61\%\)
=> x = 20 (mol)
mhh = 160.20 + 6000 = 9200 (g)

a)
Giả sử có 100 gam hỗn hợp
\(m_O=\dfrac{25.100}{100}=25\left(g\right)\)
=> \(n_O=\dfrac{25}{16}=1,5625\left(mol\right)\)
Mà nO = 4.nS
=> \(n_S=\dfrac{1,5625}{4}=\dfrac{25}{64}\left(mol\right)\)
\(\%m_S=\dfrac{\dfrac{25}{64}.32}{100}.100\%=12,5\%\)
b) Đề bài cho rồi mà bn :)
c)
C1: %mkim loại = \(100\%-12,5\%-25\%=62,5\%\)
=> mkim loại = \(\dfrac{64.62,5}{100}=40\left(g\right)\)
C2:
\(m_S=\dfrac{64.12,5}{100}=8\left(g\right)\)
\(m_O=\dfrac{64.25}{100}=16\left(g\right)\)
=> mkim loại = 64 - 8 - 16 = 40 (g)

Gọi số nguyên tử của \(Al_2(SO_4)_3\) và \(K_2SO_4\) lần lượt là x và y.
Số nguyên tử của \(Al_2(SO_4)_3\) là \(2+3+4\cdot3=17x\)
Số nguyên tử của \(K_2SO_4\) là \(2+1+4=7y\)
Mà số nguyên tử \(O_2\) trong hỗn hợp là \(4\cdot3x+4y=12x+4y\)
Theo bài: \(n_{O_2}=\dfrac{20}{31}n_{hh}\)
\(\Rightarrow12x+4y=\dfrac{20}{31}\left(17x+7y\right)\)
\(\Rightarrow y=2x\)
Có \(\%m_{Al_2\left(SO_4\right)_3}=\dfrac{342x}{342x+174y}\cdot100\%=\dfrac{342x}{342x+174\cdot2x}\cdot100\%=49,56\%\)
\(\%m_{K_2SO_4}=100\%-49,56\%=50,44\%\)
\(\%m_{\dfrac{O}{Nhôm.sunfat}}=\dfrac{4.16.3}{342}.100\approx56,14\%\\ \%m_{\dfrac{O}{Kali.sunfat}}=\dfrac{4.16}{174}.100\approx36,78\%\\ Gọi:a=n_{Al_2\left(SO_4\right)_3};b=n_{K_2SO_4}\left(a,b>0\right)\\ \Rightarrow Vì:m_{\dfrac{O}{hh}}=\dfrac{20}{31}\\ \Leftrightarrow\dfrac{a.12+b.4}{17a+7b}.100\%=\dfrac{20}{31}\\ \Leftrightarrow32a=16b\\ \Leftrightarrow\dfrac{a}{b}=\dfrac{16}{32}=\dfrac{1}{2}\\ \Leftrightarrow b=2a\\ \%m_{\dfrac{K_2SO_4}{hh}}=\dfrac{174.2a}{174.2a+342.a}.100\%\approx50,435\%\\ \Rightarrow\%m_{\dfrac{Al_2\left(SO_4\right)_3}{hh}}\approx49,565\%\)

Đáp án C
Gọi
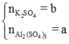
Áp dụng định luật bảo toàn nguyên tố cho O, Al, K và S ta có:
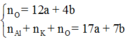
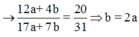
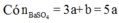
Nên
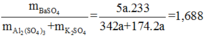
Đáp án C

Đáp án : D
Giả sử có 1 mol hỗn hợp gồm x mol Al2(SO4)3 và (1 – x) mol K2SO4
=> tổng số mol các nguyên tố
= nAl + nK + nS + nO = 2x + 2.(1 – x) + (3x + 1 – x) + 4.( 3x + 1 – x) = 10x + 7
=>nO = nngto.%nO
=> 4.(3x + 1 – x) = (10x + 7).20/31
=> x = 1/3 mol
=> mhh đầu = 230g
Khi phản ứng với BaCl2 thì nBaSO4 = nSO4 = 3x + 1 – x = 5/3 mol
=> mBaSO4 = 388,3g
=> mBaSO4 : mhh = 1,688 lần
Đặt tỉ lệ số phân tử Fe2(SO4)3 và MgSO4 là x,y
=> Số nguyên tử O: 12x + 4y
Tổng số nguyên tử: 17x +6y
Ta có:
\(\dfrac{12x+4y}{17x+6y}=\dfrac{32}{47}\Leftrightarrow47.\left(12x+4y\right)=32.\left(17x+6y\right)\\ \Leftrightarrow564x-544x=192y-188y\\ \Leftrightarrow20x=4y\\ \Leftrightarrow\dfrac{x}{y}=\dfrac{1}{5}\)
=> Phần trăm khối lượng mỗi chất trong hh:
\(\%mFe2\left(SO4\right)3=\dfrac{400.1}{400.1+120.5}.100=40\%\\ \%mMgSO4=100\%-40\%=60\%\)