3. xác định nồng độ % của dung dịch h2so4 thu được khi hòa tan 3,36 l so3 ở đkc trong 740,4 h20
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) $n_{H_2} = \dfrac{3,7185}{24,79} = 0,15(mol)$
$2R + 3H_2SO_4 \to R_2(SO_4)_3 + 3H_2$
Theo PTHH : $n_R = \dfrac{2}{3}n_{H_2} = 0,1(mol)$
$\Rightarrow R = \dfrac{2,7}{0,1} = 27(Al)$
b) $n_{H_2SO_4} = 0,15(mol) \Rightarrow m_{dd\ H_2SO_4} = \dfrac{0,15.98}{19,6\%} = 75(gam)$
$m_{dd\ sau\ pư} = 2,7 + 75 - 0,15.2 = 77,4(gam)$
$n_{Al_2(SO_4)_3} = 0,05(mol)$
$\Rightarrow C\%_{Al_2(SO_4)_3} = \dfrac{0,05.342}{77,4}.100\% = 22,9\%$

PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
Ta có: \(n_{SO_3}=\dfrac{320}{80}=4\left(mol\right)=n_{H_2SO_4}\) \(\Rightarrow C\%_{H_2SO_4}=\dfrac{4\cdot98}{320+480}\cdot100\%=49\%\)
Dung dịch sau p/ứ làm quỳ tím hóa đỏ
gì mà 4 mol SO3 lận z
nSO3=4(mol)
PTHH: SO3 + H2O -> H2SO4
mH2O=480(g) => mddH2SO4=mSO3 + mH2O=800(g)
nH2SO4=nSO3=4(mol) => mH2SO4=392(g)
=> C%ddH2SO4= (392/800).100=49%
=> QUỲ TÍM HÓA ĐỎ LÈ LÈ NÈ

\(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{SO_3}=\dfrac{12}{80}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{SO_3}=0,15\left(mol\right)\)
\(\Rightarrow C\%_{H_2SO_4}=\dfrac{0,15.98}{12+100}.100\%=13,125\%\)

\(n_{SO_3}=\dfrac{32}{80}=0,4\left(mol\right)\)
PTHH: \(SO_3+H_2O\rightarrow H_2SO_4\)
\(n_{H_2SO_4}=n_{SO_3}=0,4\left(mol\right)\)
\(m_{H_2SO_4}=0,4\cdot98=39,2\left(g\right)\)
\(m_{H_2SO_4\text{ trong dd 10%}}=\dfrac{200\cdot10}{100}=20\left(g\right)\)
\(\sum m_{H_2SO_4}=20+39,2=59,2\left(g\right)\)
\(m_{\text{ dd H2SO4 10%}}=200+39,2=239,2\left(g\right)\)
\(C\%_{\text{ dd mới}}=\dfrac{59,2}{239,2}\cdot100\%\approx24,75\%\)
Hiện tượng: SO3 được đưa vào dd H2SO4, SO3 tác dụng với H2O trong dd tạo ra sản phẩm là H2SO4.

\(n_{H_2}=\dfrac{3,36}{22,4}=0,,15(mol)\\ Fe+H_2SO_4\to FeSO_4+H_2\\ \Rightarrow n_{Fe}=n_{H_2SO_4}=0,15(mol)\\ a,m_{Fe}=0,15.56=8,4(g)\\ b,C_{M_{H_2SO_4}}=\dfrac{0,15}{0,8}=0,1875M\)

Câu 3 :
\(n_{H2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(Fe+H_2SO_4\rightarrow FeSO_4+H_2|\)
1 1 1 1
0,15 0,15 0,15
a) \(n_{Fe}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe}=0,15.56=8,4\left(g\right)\)
b) \(n_{H2SO4}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
800ml = 0,8l
\(C_{M_{ddH2SO4}}=\dfrac{0,15}{0,8}=0,1875\left(M\right)\)
Chúc bạn học tốt

\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a) \(n_{Fe}=n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
b) \(n_{H_2SO_4}=n_{HCl}=0,15\left(mol\right)\\ \Rightarrow CM_{H_2SO_4}=\dfrac{0,15}{0,8}=0,1875M\)
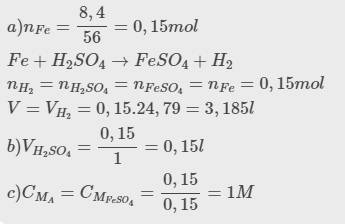
PTHH: SO3 + H2O ===> H2SO4
Ta có: nSO3 = \(\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
=> mSO3 = 0,15 x 80 = 12 (gam)
Dễ dàng CM được SO3 tan hết trong H2O
=> nH2SO4 = 0,15 (mol)
=> mH2SO4 = 0,15 x 98 = 14,7 (gam)
Mặt khác, mdung dịch sau pứ = 12 + 740,4 = 752,4 (gam)
=> C% = \(\dfrac{14,7}{752,4}.100\%=1,95\%\)