Chia a g axít axetic thành 2 phần bằng nhau.
Phần 1 trung hòa vừa đủ với 0.25l dd NaOH 0.25lít dd NaOH 0.2M.
Phần 2 thực hiện phản ứng este hóa với rượu etylic thu được m g este giả sử hiệu suất xảy ra hoàn toàn.
a/ Viết phương trình phản ứng xảy ra?
b/ Tính giá trị của a và m?


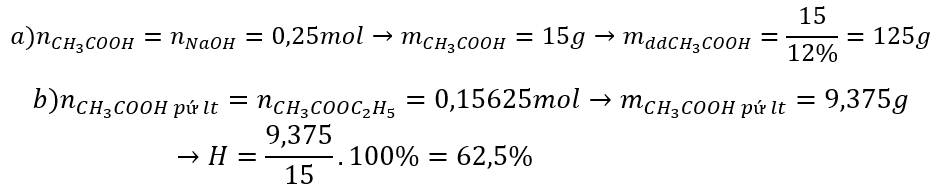
nNaOH=0,05mol
PPHH: CH3COOH+NaOH=>CH3COONa+H2O
0,05<--------0,05
=> mCH3COOH=0,05.60=3g
=> a=3.2=6( 2 phần bằng nhau)
nCH3COOH=0,05.2=0,1
PTHH: CH3COOH+C2H5OH=> CH3COOC2H5+H2O
0,1 ->0,1
=> m=0,1.88=8,8g
Đề ra là đem phần 2 đi tham gia pứ este hóa. Nên lượng axit=phần 1= 0,05mol chứ