Cho 0,01 mol Fe vào 50 ml dung dịch AgNO3 1M. Khi phản ứng xảy ra hoàn toàn thì khối lượng Ag thu được là bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


F e + 2 A g N O 3 → F e N O 3 2 + 2 A g
Ban đầu 0,01........1.0,05………mol
Phản ứng 0,01…0,02…..0,01……0,02……mol
Sau pứ 0..…0,03………0,01……0,02…mol
A g N O 3 + F e N O 3 2 → F e N O 3 3 + A g
Ban đầu 0,03………..0,01………mol
Phản ứng 0,01………...0,01……………0,01…mol
Sau pứ 0,02……..0……………0,01….mol
⇒ m A g = (0,01+0,02).108 = 3,24g
⇒ Chọn C.

Đáp án : B
Fe + 3AgNO3 -> Fe(NO3)3 + 3Ag
=> nAg = 3nFe = 0,06 mol < nAgNO3
=> mAg = 6,48g

Chọn C
nNaOH = 0,4 = nX + nHCl Þ X chỉ có 1 nhóm COOH Þ nH2O tạo thành = 0,4
BTKL Þ mX + 0,2x36,5 + 0,4x40 = 33,9 + 0,4x18 Þ mX = 17,8 gam.

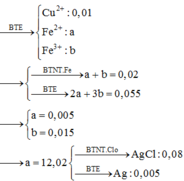

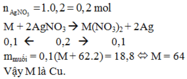
nAgNO3=0,05(mol)
nFe= 0,01(mol)
PTHH: Fe + 2 AgNO3 -> Fe(NO3)2 + 2 Ag
0,01_____0,02_______0,01___0,02(mol)
Fe(NO3)2 + AgNO3 -> Fe(NO3)3 + Ag
0,01_______0,01_______0,01____0,01(mol)
=> m(Ag)= 0,03.108= 3,24(g)
50ml = 0,05l
Số mol của dung dịch bạc nitrat
CMAgNO3 = \(\dfrac{n}{V}\Rightarrow n=C_M.V=1.0,05=0,05\left(mol\right)\)
Pt : Fe + 2AgNO3 → Fe(NO3)2 + 2Ag\(|\)
1 2 1 2
0,01 0,05 0,02
Lập tỉ số so sánh : \(\dfrac{0,01}{1}< \dfrac{0,05}{2}\)
⇒ Fe phản ứng hết , AgNO3 dư
⇒ Tính toán dựa vào số mol của Fe
Số mol của bạc
nAg = \(\dfrac{0,01.2}{1}=0,02\left(mol\right)\)
Khối lượng của bạc
mAg = nAg . MAg
= 0,02 . 108
= 2,16 (g)
Chúc bạn học tốt